
【题目】对比是学习化学的重要方法,下列关于二氧化碳和一氧化碳的比较,完全正确的是( )
A.组成:CO2、CO均由碳元素和氧元素组成
B.性质:CO2、CO都有可燃性
C.用途:CO2可用于灭火;CO可用于人工降雨
D.危害:CO2会导致酸雨;CO会引起中毒
科目:初中化学 来源: 题型:
【题目】漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应。Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)HClO在常温下分解,反应为2HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH (填“增大”或“减小”或“不变”)。
(2)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
(4)【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,。 | 有气体产生,气体使石灰水变浑浊。 | 猜想2成立 |
②在上述反应后试管中加少量。 | 。 |
(5)现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案: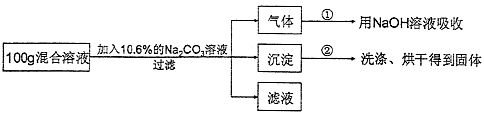
【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
m= .
(6)上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?.(不考虑过滤中的损失,计算结果保留到小数点后一位.)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是
A.金刚石硬度大能裁玻璃,石墨有导电性可做电极
B.煤炉里煤层上方的蓝色火焰是碳在充分燃烧
C.CO、CO2在空气中含量高都能使人死亡,因为它们都有毒性
D.CO2会导致温室效应,属于大气污染物之一
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A,B,C三种物质的溶解度曲线,下列说法正确的是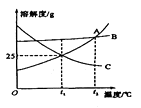 ( )
( )
A.欲除去少量混在A中的B,提纯A物质可用蒸发结晶的方法
B.t2℃时,等质量的B,C的饱和溶液中,溶剂的质量大小关系为B<C
C.t2℃时A,B,C的饱和溶液降温到t1℃时,A,C两溶液的溶质质量分数相等
D.t1℃时,A的饱和溶液的溶质质量分数为25%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为确保生命安全,下列处理事故的方法正确的是:
A.室内起火,打开门窗通风B.煤气泄漏,开灯检查
C.炒菜时油锅着火,立刻浇水灭D.进入深洞,先做灯火实验
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某CuO与C的混合物,共10 g,加热至不再有气体生成的时候,将生成的气体通入足量的澄清石灰水中,得到沉淀5 g,则原混合物中CuO的质量可能为( )
A.8 g
B.8.4 g
C.8.6 g
D.9.4 g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业炼铁是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来。计算:
(1)Fe2O3的相对分子质量是:
(2)5000t含氧化铁84%的赤铁矿中,其氧化铁的质量是 t;
(3)上述赤铁矿理论上可炼得含铁98%的生铁 t
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com