(2013?顺义区二模)浓硫酸具有吸水性,可以做干燥剂,而稀硫酸不能.好奇心强的同学提出问题:浓硫酸的浓度降低到什么程度时就不能继续做干燥剂了?为了解决这个问题,老师带同学们展开探究.
[探究1]同学们用图1的装置进行实验.B烧杯中的水能被浓硫酸吸收的根本原因是
分子在不断运动
分子在不断运动
.确认A烧杯的浓硫酸不再吸水的方法是
定期多次称量硫酸的质量,而质量不变
定期多次称量硫酸的质量,而质量不变
.
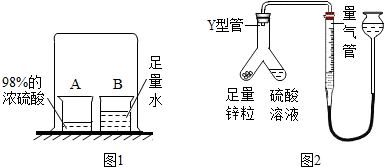
[探究2]测定探究1中吸水后硫酸溶液的溶质质量分数.
[查阅资料]H
2SO
4+BaCl
2=BaSO
4↓+2HCl;Zn+2H
2SO
4(浓)=ZnSO
4+SO
2↑+2H
2O
[设计实验]小组同学设计了如下三套方案,请协助他们完成实验方案的设计.
(1)取一定量的探究1所得待测溶液,滴加BaCl
2 至过量,
过滤、洗涤、干燥
过滤、洗涤、干燥
,称量,计算.
(2)取一定量的待测溶液加入过量氧化铁,测量消耗氧化铁的质量,计算硫酸溶液的溶质质量分数.该过程发生反应的化学方程式为
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.
(3)取一定量的待测溶液,用图2装置进行实验,利用测得的气体量,计算硫酸的质量及其浓度.该实验使Y型管中锌粒与硫酸溶液反应的正确操作是
慢慢倾斜Y型管,使锌粒滑入待测溶液中
慢慢倾斜Y型管,使锌粒滑入待测溶液中
.
[反思与评价]
(1)老师引导同学们对实验方案进行评价,提出问题:上述方案中,可行性差的是那一个?为什么?你的回答是
第三个,该方案中可能有氢气和二氧化硫两种气体产生,从而无法处理通过处理数据得出结论
第三个,该方案中可能有氢气和二氧化硫两种气体产生,从而无法处理通过处理数据得出结论
.
(2)聪明的小刚提出,整个探究过程通过一个实验就能实现,他的设想是
取一定量的浓硫酸进行探究1的实验,通过测量吸水量,计算吸水后硫酸溶液的溶质质量分数
取一定量的浓硫酸进行探究1的实验,通过测量吸水量,计算吸水后硫酸溶液的溶质质量分数
.



