
| A. | Cu、Ag | B. | Fe、Cu | C. | Mg、Fe | D. | Mg、Al |
分析 先假设收集到0.2g氢气需多少克的纯锌与足量硫酸完全反应,再与实际值作比较,若小于7克,说明合金中所含的金属在与锌相同的质量时生成氢气的质量比锌生成的氢气质量要小或不能生成氢气,从而推测另外的金属是什么.
解答 解:设收集到0.2g氢气需纯锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}$=$\frac{2}{0.2g}$
解之得:x=6.5g
则该合金中的另外的等质量的金属制取氢气的质量大于0.2克,而另外一种金属不能反应或等质量金属反应生成氢气的质量小于0.2g,根据等质量的+2价金属与足量酸反应,相对分子质量越小产生氢气的质量越大进行分析可以知道,符合题意额为B.
故选B.
点评 解决这类问题常采用的方法就是极值法.如本题中先假设产生O.2g的氢气计算出需纯锌质量再分析比较.


科目:初中化学 来源: 题型:解答题
 某研究性学习小组设计了如图所示的装置,探究空气中氧气的体积分数,其中A是底面积为50cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略).他们的操作过程如下:
某研究性学习小组设计了如图所示的装置,探究空气中氧气的体积分数,其中A是底面积为50cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略).他们的操作过程如下:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
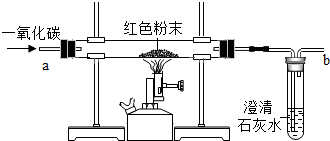
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | X | Y | Z | Q |
| 反应前质量/g | 2 | 2 | 84 | 5 |
| 反应后质量/g | 待测 | 24 | 0 | 14 |
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 氧化反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
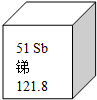 2015年11月24日上午9时,西和县陇星锑业公司崖湾山青尾矿库二号溢流井隔板破损出现漏沙.经初步勘查,约3000立方米尾沙溢出,经太石河流入西汉水.右图是锑元素在元素周期表中的相关信息,下列关于锑元素的说法不正确的是 ( )
2015年11月24日上午9时,西和县陇星锑业公司崖湾山青尾矿库二号溢流井隔板破损出现漏沙.经初步勘查,约3000立方米尾沙溢出,经太石河流入西汉水.右图是锑元素在元素周期表中的相关信息,下列关于锑元素的说法不正确的是 ( )| A. | 原子的核电荷数是51 | B. | 元素符号是Sb | ||
| C. | 属于金属元素 | D. | 相对原子质量为121.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com