
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:
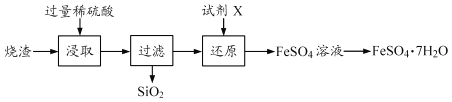
查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为
FeO+H2SO4=FeSO4+ H2O 、________________。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有______________(写2条,不考虑“搅拌”和 “使用催化剂”)。
(3)“还原”步骤的日的是将Fe抖转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y =2FeSO4+2H2SO4,则Y的化学式是_________。
②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3=3FeSO4。测得“还原”后溶液的pH明显增大,其原因是______ 。
【答案】(1) Fe2O3 +3H2SO4=Fe2 (SO4)3+3H2O
(2)增大硫酸的浓度 升高温度 将烧渣粉碎(3点中任意2点)
(3)①H2O ②铁消耗过量的硫酸,溶液酸性减弱
【解析】(1)氧化铁与稀硫酸反应生成硫酸铁和水,反应的化学方程式表示为Fe2O3 +3H2SO4=Fe2 (SO4)3+3H2O;(2)为了加快反应速率,可将烧渣粉碎以最大它与稀硫酸的接触面积,也可增大硫酸的浓度或提高温度;(3)①反应前S:4,O:14,Fe:2,反应后S:4,O:16,Fe:2,H:4,根据质量守恒定律化学反应前后原子的种类和数目不变,由于Y的化学式前有化学计量数2,故Y的化学式为H2O;②根据流程图可知加入的稀硫酸是过量的,即“还原”时溶液中含有硫酸,加入铁后,铁不仅能与硫酸铁反应,还能与稀硫酸反应,硫酸的量减少,那么酸性会减弱,酸性越弱,pH越大。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:初中化学 来源: 题型:
【题目】吸烟让自己受到伤害的同时,也造成周围的人“被动吸烟”。对其原因解释合理的是
A.分子在不断运动 B.分子的质量很小
C.分子间有间隔 D.分子由原子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在无色溶液中,下列离子组能大量共存的是( )
A.Ca2+ Na+ CO32- Cl- B.Na+ K+ OH- Cl-
C.Cu2+ K+ Cl- NO3- D.H+ Na+ OH- SO42-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中A-I表示初中化学常见的物质,且分别是由一种或两种元素组成:其中A、B、D、H均为单质;F可用作大棚蔬菜生产中的气体肥料;H在B、F、G存在的情况下可以生成铜绿[铜绿主要成分为Cu2(OH)2CO3]。图中“--”表示两端的物质间能发生化学反应:“→” 表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
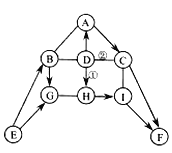
(1)写出化学式:F______, H_______。
(2)实验室常用E制取B,写出该反应的化学方程式__________________。
(3)反应①和②的基本反应类型相同,该基本反应类型是____________。
(4) 写出A→C反应的化学方程式_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】郴州是温泉之乡,温泉水中溶解了多种矿物质。下列有关水的说法错误的是( )
A.可用肥皂水检验温泉水是否属于硬水 B.温泉水是纯净物
C.活性炭可吸附水中的色素和有异味的物质 D.水能溶解很多种物质,是一种最常用的溶剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为验证Zn、Cu、Ag三种金属的活动性顺序,下列试剂可以选用的是( )
A.ZnSO4溶液 B.稀盐酸 C.AgNO3 溶液 D.CuSO4溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列叙述正确的是
A.合成材料特指合金、合成纤维、合成橡胶
B.使用一些新型的、可降解的塑料,可适当减少“白色污染”
C.人体缺少必需微量元素会得病。因此要尽量多吃含这些元素的营养补剂
D.食用碘盐可预防缺碘性贫血
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末.将少量柠檬酸和这种白色粉未溶于水,混合后产产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究:
【提出猜想】猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠
【查阅资料】①碳酸钠溶液、碳酸氢钠溶液均呈碱性;
② 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解
【实验探究】 小月、小妮分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小月 | 将白色粉末溶于水后用pH试纸测定其酸碱度 | pH_____7(填“>”、“<”或“=”) | 溶液呈碱性,猜想1成立 |
小妮 | 用下图所示的装置进行实验 | 试管A中有水珠产生,试管B中液体变浑浊 | 猜想2成立,试管B中反应的化学方程式为___________。 |
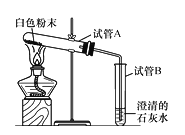
【交流反思】大家一致认为小月和小妮的结论不准确:
(1)小月实验结论不准确的原因是_____________;
(2)小妮的实验方案不能排除白色粉末是否含有_______。
【继续探究】小戚称取mg白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为n g,通过计算并分析实验数据确定猜想3正确,则n的取谊范围为_______(用含m 的代数式表示)。
【结论分析】探究后他们核查到添加剂的成分是柠檬酸和碳酸氧钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
【拓展应用】下列物质常温下放置一段时间也会分解的是_______(填序号)。
A.浓硫酸 B.氢氧化钠 C.碳酸氢铵 D.氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com