t℃时,把硫酸钠和碳酸钠的混合粉末20克,加入到100克9.8%的稀硫酸中,恰好完全反应,正好形成该温度下的饱和溶液.
求:
(1)原混合粉末中硫酸钠的质量百分含量是多少?(精确到0.1%.下同)
(2)反应中,新生成硫酸钠多少克?
(3)反应后的溶液的质量百分比浓度是多少?
(4)该温度下,硫酸钠的溶解度是多少?
解:设原混合物粉末中含有碳酸钠的质量为X,生成硫酸钠的质量为Y,生成CO
2的质量为z
Na
2CO
3 +H
2SO
4 =Na
2SO
4+H
20+CO
2↑
106 98 142 44
x 100g×9.8% y z

解得:x=10.6g
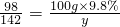
解得:y=14.2g
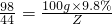
解得:z=4.4 g
(1)原混合物中硫酸钠的质量百分含量为:
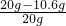
×100%=47%;
(2)反应中新生成的硫酸钠的质量是14.2克;
(3)反应后所得溶液的质量百分比浓度为:

×100%=20.4%;
(4)设t℃时,硫酸钠的溶解度为S,饱和溶液中硫酸钠的质量为:20g-10.6g+14.2g=23.6g.
S:100g=23.6g:(100g+20g-4.4g-23.6g) 解得:S=25.7g.
答:(1)原混合粉末中硫酸钠的质量百分含量是47%;(2)反应中,新生成硫酸钠14.2克;(3)反应后的溶液的质量百分比浓度是20.4%;(4)该温度下,硫酸钠的溶解度是25.7克.
分析:根据碳酸钠与稀硫酸反应的方程式,由稀硫酸中溶质的质量求出碳酸钠、生成的硫酸钠及二氧化碳的质量,再根据题意及有关的量之间的关系进行解答有关的问题.
点评:本题的综合性很强,综合了根据方程式的计算,溶液浓度及溶解度的计算.在计算时,分清各个量之间的关系是解答本题的关键.

 解得:x=10.6g
解得:x=10.6g 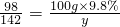 解得:y=14.2g
解得:y=14.2g 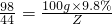 解得:z=4.4 g
解得:z=4.4 g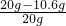 ×100%=47%;
×100%=47%;  ×100%=20.4%;
×100%=20.4%; 
