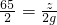解:用铜制成各种炊具,是利用它的良好的导热性;故答案为:②
(2)由题意知,反应物为铁和水蒸气、生成物为四氧化三铁和氢气、反应条件为高温,故可书写化学方程式为
3Fe+4H
2O

Fe
3O
4+4H
2;此反应符合“单质+化合物=单质+化合物,即A+BC=B+AC”,即为置换反应;
故答案为:3Fe+4H
2O(气)

Fe
3O
4+4H
2 置换
(3)由于在金属活动性顺序中,铁在锌后铜前,因此发生的反应只有Fe+CuSO
4=Cu+FeSO
4 铁在和硫酸铜反应生成铜、氢气的同时也生成了硫酸亚铁,因此在滤液中一定有硫酸亚铁,还有没有参与反应的硫酸锌.
故答案为:FeSO
4、ZnSO
4(4)①因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等.故D符合;
②假设Fe、Mg、Zn 三种金属分别跟稀盐酸充分反应,得到氢气的质量都是2g,
设参与反应的Fe的质量为x,Mg的质量为y,Zn的质量为z,
Fe+2HCl=FeCl
2+H
2↑,Mg+2HCl=MgCl
2+H
2↑,Zn+2HCl=2ZnCl
2+H
2↑,
56 2 24 2 65 2
x 2g y 2g z 2g
∴

=

,
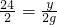
,
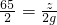
解之得:x=56g,y=24g,z=65g,
故Mg、Zn、Fe的质量比为:24g:65g:56g=24:65:56.
故B符合;C不符合;
故选BD.
分析:(1)物质的结构决定物质的性质,物质的性质决定物质的用途.
(2)由题意知,反应物为铁和水蒸气、生成物为四氧化三铁和氢气、反应条件为高温,故可书写化学方程式;由化学方程式判定反应类型;
(3)记住金属活动性顺序,金属和盐反应生成新的金属必须是前面的金属可以把排在后面的金属从盐溶液中置换出来.
(4)Fe、Mg、Zn三种金属分别跟稀盐酸反应的化学方程式为:Fe+2HCl=FeCl
2+H
2↑,Mg+2HCl=MgCl
2+H
2↑,Zn+2HCl=2ZnCl
2+H
2↑,由此可知,产生氢气的是盐酸中的氢离子,故要得到相同质量的氢气有两种情况:①参与反应的HCl的质量相等;②参与反应的Fe、Mg、Zn的质量符合得到相同质量的氢气的条件.
点评:四选项利用化学方程式和假设法解答问题较简单.在利用化学方程式解答问题时,运用假设法,对解题有很大作用.培养学生分析问题、解决问题的能力.


 Fe3O4+4H2;此反应符合“单质+化合物=单质+化合物,即A+BC=B+AC”,即为置换反应;
Fe3O4+4H2;此反应符合“单质+化合物=单质+化合物,即A+BC=B+AC”,即为置换反应;  Fe3O4+4H2 置换
Fe3O4+4H2 置换 =
= ,
,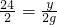 ,
,