(1)某氧化物既能跟某些金属氧化物反应,又能跟某些非金属氧化物反应,但反应后都不生成盐.请写出该氧化物分别与金属氧化物、非金属氧化物反应的化学方程式各一例: , .
(2)人的胃液中含有少量某种酸,可以帮助消化,这种酸是 (填名称).胃酸过多的病人,可服用胃舒平(有效成分是氢氧化铝),其原理用化学方程式表示为 ,也可以服用含小苏打(NaHCO3)的药品,其原理用化学方程式表示为 .
(3)若10g碳酸钙与100g稀盐酸恰好完全反应,则在100g稀盐酸中,溶质的化学式为 ,其质量为 g;完全反应后,所得溶液的质量为 g.
【答案】
分析:(1)运用某氧化物既能跟某些金属氧化物反应,又能跟某些非金属氧化物反应,但反应后都不生成盐这一信息结、水能和氧化钙生成氢氧化钙还能和二氧化碳生成碳酸、氢氧化钙和碳酸都不属于盐解答.
(2)运用胃液的成分和盐酸的化学性质解答.
(3)运用化学方程式CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑进行计算
解答:解:(1)水能和氧化钙生成氢氧化钙还能和二氧化碳生成碳酸,氢氧化钙和碳酸分别属于碱和盐,所以水符合要求故答案:CaO+H
2O=Ca(OH)
2 CO
2+H
2O=H
2CO
3 (2)胃液的主要成分是盐酸,盐酸和氢氧化铝反应生成氯化铝和水,盐酸还可与碳酸氢钠反应生成氯化钠、水和二氧化碳,故答案:盐酸 3HCl+Al(OH)
3=AlCl
3+3H
2O
NaHCO
3+HCl=NaCl+H
2O+CO
2↑,生成二氧化碳的质量为y,
(3)设100g稀盐酸中溶质的质量为x,
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 73 44
10g x y
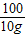
=
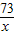
x=7.3g

=
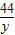
y=4.4g
根据质量守恒定律可知:10g+100g-4.4g=105.6g
故(3)答案:HCl 7.3 105.6
点评:本题考查了物质的推断、盐酸的化学性质、化学方程式的书写、根据化学方程式的计算、质量守恒定律的应用,要做好推断题必须熟练掌握所学物质的性质.

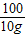 =
=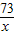
 =
=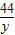


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案