解:(1)A.由铝的原子结构示意图的意义可知,铝原子的质子数为13.故A说法正确;
B.由铝的原子结构示意图的意义可知,铝原子最外层的电子数是3,在反应中常失去3个电子,化合物中铝元素通常显+3价.故B说法正确;
C.铝是地壳中含量最多的金属元素.故C说法错误;
D.铝可作导线是由于它具有良好的导电性.故D说法正确.
(2)工业上用CO和赤铁矿石炼铁的化学方程式为:3CO+Fe
2O
3
2Fe+3CO
2;
(3)由题意可知,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象;说明了Fe、R的活动性大于氢,Cu的活动性小于氢;由将 FeSO
4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,说明了R的活动性大于铁,Cu的活动性小于铁,综上所述可知,则金属H、Fe、R、Cu活动性由强到弱的顺序是:R>Fe>H>Cu;
(4)猜想1:当加入的锌粉时足量的,就能将溶液中银、铜的全部置换出来,溶液中只有Zn(NO
3)
2,故猜想1正确;
猜想2:猜想②中无硝酸铜,说明Cu(NO
3)
2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜;故猜想②是错误的;
猜想3:当加入的锌粉时不足量的,只能将溶液中银的全部置换出来,溶液中有Zn (NO
3)
2、Cu(NO
3)
2,故猜想3正确;
猜想4:当加入的锌粉时较少的,只能将溶液中银的部分置换出来,溶液中有Zn (NO
3)
2、AgNO
3、Cu(NO
3)
2,故猜想4正确;
由上述分析可知猜想1成立,说明锌把硝酸银、硝酸铜都反应完了,由锌与酸的反应可知,取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物.
故答为:(1)C; (2)3CO+Fe
2O
3
2Fe+3CO
2;(3)R>Fe>H>Cu;(4)猜想2;猜想②中无硝酸铜,说明Cu(NO
3)
2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物.
分析:(1)根据原子结构示意图的意义、铝的性质、在地壳中的含量分析判断;
(2)根据炼铁的原理写出反应的方程式;
(3)根据金属与酸、盐的反应判断金属的活动性顺序;
(4)根据铜能与硝酸银反应考虑是否存在硝酸银;只要是锌过量滤液中只含有硝酸锌,检验锌过量就是利用锌与酸反应来考虑;根据锌与酸的反应可以判断出固体B的成分.
点评:本题容易出错的地方是对几种猜想正误的判断,要知道铜能与硝酸银反应,只要有一种金属剩余,则排在该金属后面的金属阳离子就不存在.

 金属结构和性质等是化学研究的重要内容.
金属结构和性质等是化学研究的重要内容. 2Fe+3CO2;
2Fe+3CO2; 2Fe+3CO2;(3)R>Fe>H>Cu;(4)猜想2;猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物.
2Fe+3CO2;(3)R>Fe>H>Cu;(4)猜想2;猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物.

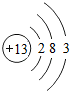 ,铝原子核内中子数比质子数多1,则铝原子的中子数为
,铝原子核内中子数比质子数多1,则铝原子的中子数为 ,铝原子核内中子数比质子数多1,则铝原子的中子数为______;
,铝原子核内中子数比质子数多1,则铝原子的中子数为______; ,铝原子核内中子数比质子数多1,则铝原子的中子数为 ;
,铝原子核内中子数比质子数多1,则铝原子的中子数为 ;