
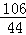 =
=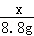 ;(3)80%;(4)1:5;(5)26.5t.
;(3)80%;(4)1:5;(5)26.5t.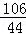 =
=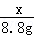 解得:x=21.2g
解得:x=21.2g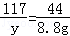 解得:y=23.4g
解得:y=23.4g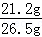 ×100%=80%;
×100%=80%;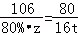


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:初中化学 来源:不详 题型:计算题
| 次数 | 1 | 2 | 3 | 4 |
| 加入Ca(OH)2溶液的质量/克 | 100 | 100 | 100 | 100 |
| 烧杯中生成沉淀的质量/克 | 1 | m | 3 | 3 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 4.6 | 8.0 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 5.4 | 4.4 | a |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.12% | B.24% | C.20% | D.30% |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 小刚根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为 ;
小刚根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为 ;查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com