
 生活中常用的清洗剂.
生活中常用的清洗剂.| 名称 | 洁厕灵 | 炉具清洁剂 | 高效去污粉 | 消毒液 |
| 产品 样式 |  |  |  |  |
| 有效成分 | 盐酸 | 氢氧化钠 | 碳酸钠 | NaCl和NaClO |
分析 (1)根据盐酸和氢氧化钠反应生成氯化钠和水写出反应的方程式;根据离子反应原理知生成物氯化钠以氯离子和钠离子形式存在,水主要以水分子存在分析a;
(2)根据碳酸钠和盐酸反应产生氯化钠、水和二氧化碳写出反应的方程式;
(3)根据在化合物中,正负化合价的代数和为零的原则,计算出NaClO中Cl的化合价为+1价;根据方程式书写的原理写出反应的方程式.
解答 解:(1)将洁厕灵与炉具清洁剂混合是盐酸和氢氧化钠反应生成氯化钠和水,反应的方程式为:NaOH+HCl═NaCl+H2O;盐酸和氢氧化钠反应,根据离子反应原理知生成物氯化钠以氯离子和钠离子形式存在,水主要以水分子存在,因此a微粒是水分子,符号为:H2O;
故答案为:NaOH+HCl═NaCl+H2O;H2O;
(2)高效去污粉中加入足量的洁厕灵是碳酸钠和盐酸反应产生氯化钠、水和二氧化碳,反应的方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
(3)根据在化合物中,正负化合价的代数和为零的原则,计算出NaClO中Cl的化合价为+1价,而氯化钠中Cl的化合价为-1价;
工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,成分为NaCl和NaClO,根据元素守恒可知生成物中还有水,因此反应的方程式为:2NaOH+Cl2 ═NaCl+NaClO+H2O;
故答案为:NaClO; 2NaOH+Cl2 ═NaCl+NaClO+H2O.
点评 本题主要以日常生活中常用的清洁剂为素材,考查了学生运用化学知识解决实际问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | 一种原子只能构成一种分子 | |
| B. | 质子数相等的粒子一定属于同种元素 | |
| C. | 原子得失电子形成离子时,其电子层数可能有变化 | |
| D. | 同种元素的粒子,其核外电子数一定相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
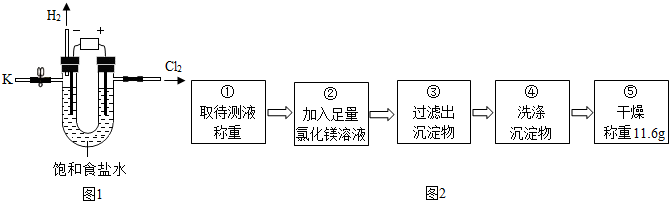
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 铝丝插入硫酸铜溶液中,铝丝表面有红色物质析出,溶液由蓝色变成无色 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 铜与稀硫酸反应速率较慢,产生少量气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com