



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| 1H 氢 |
2He 氦 | ||||||
| 3Li 锂 |
4Be 铍 |
5B 硼 |
6C 炭 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 |
| 11Na 钠 |
12Mg 镁 |
13Al 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
17Cl 氯 |
18Ar 氩 |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
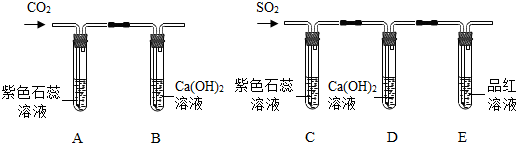
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?册亨县模拟)纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示(计算结果保留到小数点后一位).求:
(2013?册亨县模拟)纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示(计算结果保留到小数点后一位).求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com