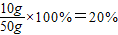某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入25%的硫酸溶液,边滴边搅拌至溶液颜色恰好变为无色(完全反应)为止,共消耗硫酸溶液49g.
(1)写出反应的化学方程式:______.
通过计算回答下列问题:
(2)硫酸的相对分子质量为:______.
(3)49g 25%的硫酸溶液中溶质的质量为:______.
(4)50g待测氢氧化钠溶液中溶质的质量为:______.
(5)待测氢氧化钠溶液的溶质质量分数为:______.
【答案】
分析:(1)依据反应事实结合方程式的书写要求完成即可;
(2)依据相对分子质量等于各元素相对原子质量之和完成;
(3)利用溶质的质量等于溶液的质量乘以溶质的质量分数解决.
(4)利用硫酸的质量通过方程式求氢氧化钠的质量;
(5)利用溶质质量分数的计算要求求溶质的质量分数.
解答:解;(1)氢氧化钠与硫酸的反应方程式是:2NaOH+H
2SO
4=Na
2SO
4+2H
2O
(2)相对分子质量等于各元素相对原子质量之和,所以硫酸的相对分子质量为:1×2+32+16×4=98;
(3)溶质的质量等于溶液的质量乘以溶质的质量分数,则硫酸的质量是49g×25%=12.25g
(4)根据酸的质量求氢氧化钠的质量,再利用氢氧化钠溶液的质量求溶液的溶质质量分数.
设反应消耗NaOH的质量为x
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
2×40 98
x 12.25g
x=
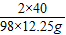
=10g
(5)待测氢氧化钠溶液的溶质质量分数为:
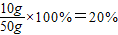
故答案为:(1)2NaOH+H
2SO
4=Na
2SO
4+2H
2O(2)98(3)12.25g(4)10g(5)20%
点评:此题是对溶液进行的综合计算,涉及到溶质质量的计算、方程式的计算,解决此题对学生计算能力的提高有一定好处.

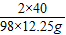 =10g
=10g