
【题目】人类社会发展离不开金属材料。
(1)图1是某硬铝的主要成分。将适量硬铝(已用砂纸打磨处理)放入足量稀硫酸中,反应的化学方程式有________________。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,出现蓝色的原因是________________,写出此时溶液中所含的阳离子:________________。
(3)相同条件下,取相同状态的金属钪(Se)和铝分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Se________________Al(填“>”或“<”)。根据上述结论,下列说法中不正确的是___________(填字母序号)。
A 将Se投入CuSO4溶液中有红色物质析出
B 仅用Fe(NO3)2溶液、Se( NO3)3溶液、Ag能验证钪和铁的活动性强弱
C 仅用Fe、Se、稀H2SO4溶液能验证钪和铁的活动性强弱
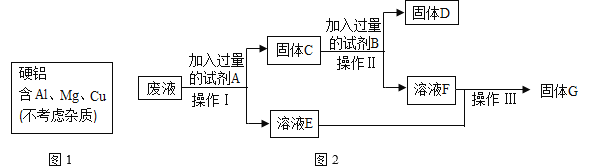
(4)想从含有氯化亚铁、氯化铜的废液中回收金属铜和氯化亚铁晶体.设计了图2所示实验方案。
①操作I的名称是____。
②操作II中加入过量的试剂B的目的是_______________________。
③操作Ⅲ除去的物质是______________________(填化学式)。
【答案】![]() 、
、 ![]() 溶液中有Cu 2+产生[或Cu和AgNO3反应生成了Cu(NO3)2,Cu(NO3)2溶液呈蓝色 ] Cu 2+ 、Al 3+、Mg 2+ > B 过滤 除去多余的铁粉 H2O
溶液中有Cu 2+产生[或Cu和AgNO3反应生成了Cu(NO3)2,Cu(NO3)2溶液呈蓝色 ] Cu 2+ 、Al 3+、Mg 2+ > B 过滤 除去多余的铁粉 H2O
【解析】
(1)硬铝的主要成分铝、镁和铜。将适量硬铝放入足量稀硫酸中,铝和镁能与硫酸反应,反应的化学方程式分别是![]() 、
、![]() 。
。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,说明铜与硝酸银溶液反应,生成硝酸铜和银,所以出现蓝色的原因是溶液中有Cu 2+产生。铜都参与了反应,则硬铝中的铝和镁也肯定参与了反应,且已经反应完,所以反应后溶液中的溶质有硝酸铝、硝酸镁和硝酸铜,因为硬铝粉是足量,所以硝酸银溶液全部被反应完,故此时溶液中所含的阳离子有:Cu 2+ 、Al 3+、Mg 2+。
(3)相同条件下,取相同状态的金属钪(Se)和铝分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Se>Al。根据上述结论,选择不正确的说法。
A、因为钪的活动性强于铝,铝的活动性强于铜,则钪的活动性也强于铜。故将Se投入CuSO4溶液中有红色物质析出,A正确;
B、根据这三种金属的活动性,银与Fe(NO3)2溶液或Se( NO3)3溶液不反应,无明显现象产生,故仅用Fe(NO3)2溶液、Se( NO3)3溶液、Ag无法验证钪和铁的活动性强弱,B不正确;
C、已知金属活动性Se>Al,Al > Fe,把Fe和Se分别放入相同的稀H2SO4溶液中,钪产生气泡速率明显更快,故能验证钪和铁的活动性强弱,C正确。故选B。
(4)①加试剂A,通过操作I可以使混合物中固体和液体分离,则操作I是过滤。
②加入的试剂A应该是铁粉,则固体C中含有铜和铁,在操作II中加入过量的试剂B,试剂B为稀盐酸,目的是除去多余的铁粉。
③通过操作Ⅲ可以从氯化亚铁溶液中得到氯化亚铁晶体,故除去的物质是H2O 。


科目:初中化学 来源: 题型:
【题目】氧元素是地壳中含量最高的元素,请回答下列问题
(1)画出氧原子结构示意图_______________。
(2)元素周期表中氧元素的信息如图所示,从图中能直接获得的信息是 。
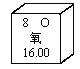
A.氧元素属于非金属元素
B.氧原子的核内的质子数为16
C.氧元素有O2和O3两种单质
(3)下图是硫化氢(H2S)在氧气中不完全燃烧反应的微观示意图。

写出该反应的化学方程式 ,该反应属于 (填基本反应类型)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是( )
序号 | A | B | C | D |
目的 | 证明二氧化碳溶于水且能和水反应 | 证明碳与氧化铜能发生反应 | 探究同种溶质在不同的溶剂的溶解性 | 探究燃烧的条件是燃烧需要氧气 |
方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一包白色固体,其中含有Na2CO3,还可能含有Ba(NO3)2、Na2SO4、NaOH中的一种或几种。取该固体进行以下实验:取少量固体于烧杯中,加入足量水并不断搅拌,固体部分溶解;接着向烧杯中加入足量稀硝酸并不断搅拌,此时固体质量变化如图所示。下列说法错误的是
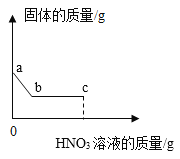
A.a→b段对应的实验现象是固体部分溶解,有气泡产生
B.b→c段对应的溶液pH逐渐减小
C.原白色固体中一定含有NaOH
D.c点对应的溶液中一定含有NaNO3、HNO3、Ba(NO3)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将氯化钠和氯化铜的固体混合物20g完全溶于100g水中,再向所得的溶液中加入溶质质量分数为10%的NaOH溶液。有关的变化如图所示。(反应的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl)请计算:
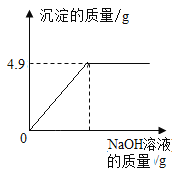
(1)NaOH中氧元素和氢元素的质量比为______________。
(2)求恰好完全反应时,所用NaOH溶液的质量。(写出计算过程)
(3)求恰好完全反应时溶液中溶质的质量分数。(写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组欲探究实验室的一包白色固体( 已知含碳酸钠)的具体成分 。
他们猜测可能含有硝酸钡、硫酸钠、氢氧化钠中的一种或几种。 通过查阅资料发现硝酸钡溶于水呈中性,硫酸钠溶于水呈弱碱性。以下是实验步骤:
步骤一:取少量白色固体于烧杯中.向烧杯中加入足量水并不断搅拌,固体部分溶解。
步骤二:接着向烧杯中加入足量稀硝酸并不断搅拌,测定固体质量变化,并画出如图所示图象。
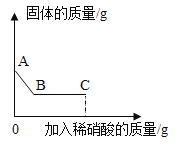
(1)步骤一的实验目的是_______________________________________;
(2)步骤二中他们观察到的现象是_____________________________;综合步骤一、步骤二能确定该白色粉末中一定含有_____________________________。
(3)若要继续确定该白色粉末的成分,请你设计实验方案:
实验操作 | 预期实验现象 | 实验结论 |
____ | _____ | ____ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知铜绿[Cu2(OH)2CO3]在加热时分解生成A、B、C三种常见的氧化物,下如图是有关物质之间的转化关系图示.
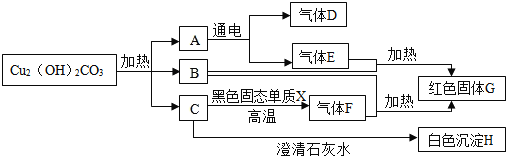
(1)试通过分析推断,写下列物质的化学式:
C.__,F.__,X.__,G.__.
(2)写出A通电时发生反应的化学方程式__,并写出基本反应类型:__
(3)写出生成气体F所涉及的化学方程式__.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将7g废铁屑放入盛有100g7.3%稀盐酸的烧杯中,恰好完全反应(假设杂质不参加反应)。此时测得烧杯内各物质的总质量为106.8g。计算:(有关反应的化学方程式为:Fe+2HCl=FeCl2+H2↑)
(1)稀释_____g20%的盐酸溶液可得100g7.3%的稀盐酸。
(2)反应产生氢气的质量为_____g。
(3)废铁屑中铁的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学的发展与人类的生活、生产息息相关。
(1)芋头皮内含有碱性黏液,皮肤沾上会出现瘙痒,可用厨房中_____来止痒。
(2)医疗上常用3%的过氧化氢溶液进行伤口消毒,消毒时常看到有气泡产生,产生这一现象的原理是_____(用化学方程式表示)。
(3)金属镁在空气中燃烧除了生成氧化镁,还可以生成氮化镁(Mg3N2)固体,氮化镁与水反应,生成氢氧化镁和氨气,氨气可以用于制得固体化肥氯化铵,请写出氮化镁与水反应的化学方程式_____。
(4)酒精是清洁燃料之一,写出酒精完全燃烧的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com