
| A. | 工业生产中都可以使用硬水 | B. | 实验剩余药品放回原瓶 | ||
| C. | 洗洁精能除去餐具上的油污 | D. | 回收地沟油,用作食用油 |
科目:初中化学 来源: 题型:选择题
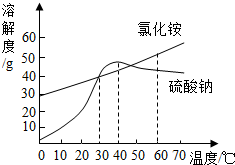 如图是氯化铵和硫酸钠的溶解度曲线示意图,由此得到的结论正确的是( )
如图是氯化铵和硫酸钠的溶解度曲线示意图,由此得到的结论正确的是( )| A. | 只有在 30℃时,两种物质的溶解度才相等 | |
| B. | 硫酸钠的溶解度随温度升高而增大 | |
| C. | 40℃时硫酸钠饱和溶液比氯化铵饱和溶液溶质质量分数大 | |
| D. | 40℃时,将硫酸钠溶液的温度升高,有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
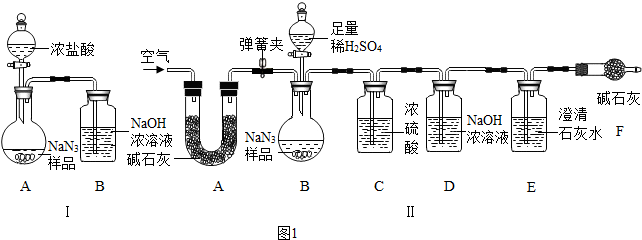
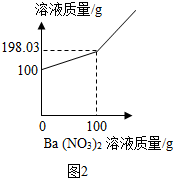
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
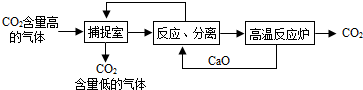
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com