
 ×100%=50%;
×100%=50%; ×100%≈57.1%;故A不适合;
×100%≈57.1%;故A不适合;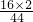 ×100%≈72.7%;故B不适合;
×100%≈72.7%;故B不适合;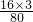 ×100%=60%;故C不适合;
×100%=60%;故C不适合;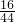 ×100%≈36.4%;故D适合.
×100%≈36.4%;故D适合.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:044
|
过氧乙酸 (质量:500 g/瓶) 成分 名称 化学式 质量分数 过氧乙酸 C2H4O3 40% 水 H2O 55% 双氧水 H2O2 5% 性 质:强氧化性、酸性 主要用途:强氧性、酸性 储存方法:密封、避光、避热,不可与可燃物混合存放,防猛烈撞击。 |
(1)从标签上的文字说明可以推知:过氧乙酸之所以避热储存,是因为过氧乙酸受热时像双氧水一样,容易发生分解,生成乙酸和一种单质气体。过氧乙酸加热分解的化学方程式是________________________________________________。
(2)一瓶这种溶液中含过氧乙酸溶质多少克?
(3)0.5%的过氧乙酸溶液可以杀死细菌和SARS病毒。某医院需配制0.5%的过氧乙酸,一瓶这种过氧乙酸需加水多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com