
| 选项 | 物质 | 方法 |
| A | NaCl(CaCl2) | 加入适量Na2CO3溶液,过滤、洗涤、干燥 |
| B | N2 (O2) | 通入灼热的铜网 |
| C | NaOH溶液(Ca(OH)2) | 加入过量碳酸钠溶液,充分反应后过滤 |
| D | CaO粉末(CaCO3) | 加入适量稀盐酸,充分搅拌后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、CaCl2能与适量Na2CO3溶液反应生成碳酸钙沉淀和氯化钠,再过滤即可,故选项所采取的方法错误.
B、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、Ca(OH)2能与过量碳酸钠溶液应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,故选项所采取的方法错误.
D、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:B.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A.化学与生活 | B.化学与环境 |
| ①生活中常用加热煮沸的方法软化硬水②用燃烧的方法区分羊毛和涤纶 ③利用洗洁精的乳化作用去除油污 | ①焚烧植物秸秆不会造成空气污染 ②PM2.5是造成雾霾天气的原因之一 ③含磷洗涤剂的使用会导致水污染 |
| C.化学与安全 | D.化学与健康 |
| ①炒菜油锅着火可以用锅盖盖灭 ②在室内放一盆水,可防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 | ①人体缺铁会引起贫血 ②用甲醛的水溶液浸泡海产品保鲜 ③食用蔬菜和水果来补充维生素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 拉瓦锡得出了空气是由氧气和氮气组成的结论 | |
| B. | 俄国化学家门捷列夫制得了第一张元素周期表 | |
| C. | 汤姆森发现了电子,证实原子是可分的 | |
| D. | 我国化学家侯德榜在工业制烧碱的研究中取得了巨大成就 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
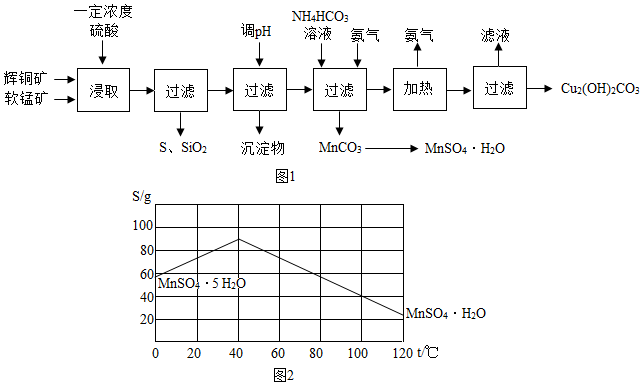
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com