
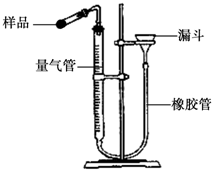
 过氧化钙(CaO2)广泛应用于水产养殖、污水处理等领域,是优良的供养剂.
过氧化钙(CaO2)广泛应用于水产养殖、污水处理等领域,是优良的供养剂.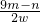 ×100%.此方案测定结果偏小的原因可能是________.
×100%.此方案测定结果偏小的原因可能是________.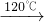 CaO2+8H2O;
CaO2+8H2O;
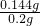 ×100%=72%
×100%=72%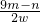 ×100%变小,从而使测定结果偏小.
×100%变小,从而使测定结果偏小. CaO2+8H2O;
CaO2+8H2O;

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| a.取在空气久置的少量固体于试管中,加足量水 | 未见固体明显溶解 | 固体不易溶于水 固体不易溶于水 |
| b.向试管中滴加几滴紫色石蕊试液 | 未见明显的颜色变化 | 固体中没有氢氧化钙 固体中没有氢氧化钙 |
| c. 向试管中滴加少量稀盐酸 向试管中滴加少量稀盐酸 |
有气泡产生 有气泡产生 |
固体成分是碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2).
(2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2).| 实验步骤 | 可能出现的现象 | 解释与结论 |
| 取反应后试管中的上层清液,加入 碳酸钠 碳酸钠 |
澄清石灰水变浑浊 澄清石灰水变浑浊 |
写出有关反应化学方程式(或解释出现现象的原因): Ca(OH)2+Na2CO3═CaCO3↓+2NaOH Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 则CaO2与H2O反应,所得含钙产物中含有 OH- OH- (填阴离子的符号),即有Ca(OH)2生成. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
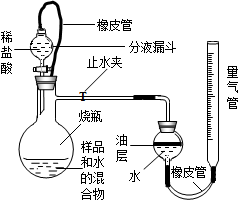 (2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
(2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com