
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。

A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入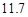 g
NaCl和
g
NaCl和 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
|
物质 |
NaCl |
NH4HCO3 |
NH4Cl |
NaHCO3 |
|
溶解度/g |
|
|
|
|
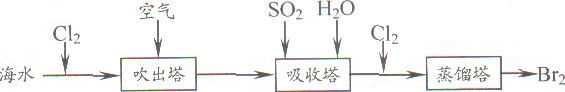
(5)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2)。流程示意图如下:
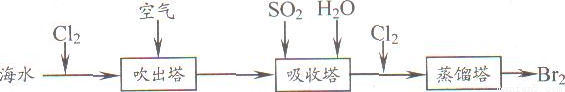
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。
(1)蛋白质 (2)太阳能 B (3)硫酸钠 碳酸钠 过滤 稀盐酸(写化学式也可)
(4)7.2 (5)①Cl2+2NaBr=Br2+2NaCl pH试纸 ②分离空气和溴
【解析】
试题分析:(1)根据六大营养素的食物来源分析,食用海鱼摄取的主要营养素是蛋白质。
(2)根据图示可知,海水淡化装置中利用的能源是太阳能;蒸馏水是一种物质组成的,属于纯净物,且是由氢、氧两种元素组成的,故属于化合物,故选B。
(3)根据粗盐中含有的杂质CaCl2、Na2SO4的性质分析,先加入的BaCl2可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,从而除去硫酸钠;而另一杂质CaCl2和剩余的BaCl2,可用碳酸钠与之反应,生成氯化钠和碳酸钙沉淀、碳酸钡沉淀,由于生成的物质均是沉淀和氯化钠,所以可通过过滤来除去;由于碳酸钠溶液过量,故有剩余,需加入稀盐酸与之反应生成氯化钠、水和二氧化碳,从而将之除去。
(4)化学方程式中,各物质的质量关系如下:
NaCl+ NH4HCO3=NaHCO3+NH4Cl
58.5 79 84 53.5
11.7g 15.8g 16.8g 10.7g
即反应生成的碳酸氢钠的质量为16.8g,生成氯化铵的质量为10.7g,再结合题中的溶解度表可知,20℃时100g水中最多能够溶解碳酸氢钠的质量为9.6g,能够溶解氯化铵的质量为37.2g,所以生成的16.8g的碳酸氢钠不能完全溶解,故有晶体析出,且析出的晶体的质量为16.8g-9.6g=7.2g。
(5)①根据题意,氯气能置换出溴化钠中的溴,而生成溴单质和氯化钠,故反应的化学方程式为Cl2+2NaBr=Br2+2NaCl;常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度。
②根据反应的方程式Br2+SO2+2H2O=H2SO4+2HBr分析,可知通入SO2的目的是使溴与空气相互分离。
考点:生命活动与六大营养素,纯净物和混合物的判别,氯化钠与粗盐提纯,固体溶解度的影响因素,根据化学方程式的计算,书写化学方程式,溶液酸碱度的测试方法
点评:本题是以海洋资源的合理开发与利用为背景,考查了包括物质的分类知识、除杂的原理和方法,以及方程式的书写与计算等多个知识点,要想解答好这类题目,就要理解和熟记与之相关的知识,并能按照题目要求进行认真分析和解答,同时要求学生在日常的学习中,要注意基础知识和基本技能的学习与训练。


科目:初中化学 来源: 题型:阅读理解
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

查看答案和解析>>
科目:初中化学 来源:2013届江苏扬州市树人中学九年级第一次模拟考试化学试卷(带解析) 题型:探究题
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入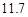 g NaCl和
g NaCl和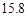 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 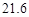 |  | 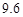 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

查看答案和解析>>
科目:初中化学 来源:2013年江苏省扬州中学树人学校中考化学一模试卷(解析版) 题型:填空题
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com