
分析 (1)人类需要的营养物质有糖类、油脂、蛋白质、维生素、水和无机盐;
(2)氢气在空气中燃烧能够生成水;
(3)煅烧石灰石可以生成氧化钙和二氧化碳;
(4)铁与水和氧气同时接触时容易生锈;
(5)溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量-溶质的质量,溶液稀释前后溶质的质量不变.
解答 :(1)人体摄取的有机物主要有糖类、油脂、蛋白质和维生素等;人体缺乏钙元素可能导致骨质疏松.故填:维生素;
(2)氢气在空气中燃烧的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.故填:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
(3)高温煅烧石灰石可以生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
(4)铁锅暴露在潮湿的空气中容易生锈,因此使铁锅保持干燥或给铁锅涂一层植物油,就可以防止铁锅生锈.故填:不用时保持铁锅干燥或涂一层植物油;
(5)要配制150kg16%的氯化钠溶液,需要氯化钠150kg×16%=24kg;m水=m液-mNaCl=150kg-24kg=126kg;
故填:24;126
点评 本题主要考查营养物质、金属的锈蚀与防护、化学方程式的书写等方面的知识,书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
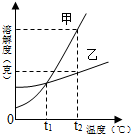
| A. | t1℃时,甲、乙两种物质的溶解度相等 | |
| B. | 若固体甲中含有少量乙时可用蒸发结晶方法提纯甲 | |
| C. | t2℃用等质量的甲、乙两种物质配制甲、乙的饱和溶液需要水的质量甲小于乙 | |
| D. | 已知t2℃甲的溶解度为50g,在t2℃时将50g甲物质加入到50g水中,充分溶解得到75g溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,所以可以做某些气体的干燥剂 | |
| B. | 患胃酸过多症的病人可口服含有NaHCO3或Al(OH)3的药物缓解胃酸过多 | |
| C. | 酸碱生成盐和水的反应,既是中和反应,又属复分解反应 | |
| D. | 稀释浓硫酸时一定要将水慢慢注入浓硫酸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ④⑤②③⑥①⑤ | B. | ④⑤②③①⑥⑤ | C. | ⑤②③⑥④①⑤ | D. | ④①⑤③⑥①⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 25℃时,氢氧化钠沉淀的pH范围 | |||
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全的pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
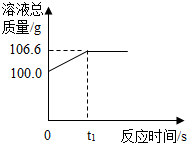 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com