一适量的镁条加到盛有稀硫酸和硫酸铜的混合溶液中,恰好三种物质完全反应,反应后生成的不溶性固体是原镁条质量的2倍,求原混合溶液中硫酸和硫酸铜的质量的最简整数比是多少?
解:设镁条为m克,生成不溶物Cu的质量为2m克,混合溶液中H
2SO
4为x克,CuSO
4y克,跟CuSO
4反应的Mg为z克,
Mg+CuSO
4=MgSO
4+Cu
24 160 64
z y 2m
∴
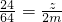
∴z=
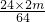
=0.75m;
∴
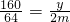
∴y=

=5m;
Mg+H
2SO
4=MgSO
4+H
2↑
24--98
m-0.75m,x
∴
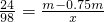
∴x=
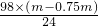
=1.02m;
x:y=1.02m:5m≈1:5.
答:原混合溶液中硫酸和硫酸铜的质量的最简整数比是1:5.
分析:由已知条件可知,反应后生成的不溶性固体是Cu,设镁条为m克,生成不溶物Cu的质量为2m克,混合溶液中H
2SO
4为x克,CuSO
4y克,跟CuSO
4反应的Mg为z克,利用镁与硫酸铜反应的化学方程式,得出硫酸铜的质量和反应的镁质量的代数式;然后再利用镁与硫酸反应的化学方程式,得出硫酸的质量的代数式;然后两者比较即可.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

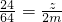
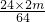 =0.75m;
=0.75m;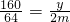
 =5m;
=5m;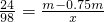
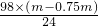 =1.02m;
=1.02m;

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案