
 材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.
材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.分析 (1)有机合成材料简称合成材料,要判断是否属于合成材料,可抓住三个特征:有机物、合成、高分子化合物,据此常见材料的分类进行分析判断.
(2)铝在一定条件下与氧化铁反应得到融熔的铁与另一种氧化物,由质量守恒定律,反应前后元素种类不变,该氧化物是氧化铝,据此进行分析解答.
(3)根据铝的性质、溶液的浓度逐渐降低分析回答;
解答 解:
(1)有机合成材料必须具备三个特征:人工合成、有机物、高分子.主要包括塑料、合成纤维和合成橡胶,故填:D;
(2)铝在一定条件下与氧化铁反应得到融熔的铁与另一种氧化物,由质量守恒定律,反应前后元素种类不变,该氧化物是氧化铝,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.两种产物为:Fe、Al2O3.
(3)在0~t1时间段内,铝箔表面看不到明显的气泡,原因是:铝在空气中被氧气氧化,生成一层致密的氧化铝保护膜,阻止铝与稀盐酸反应;t1~t3时间段内发生的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,t2~t3时间段产生气泡速度放缓的原因是稀盐酸的溶质质量分数在反应中逐渐降低.
答案:
(1)D;
(2)Fe、Al2O3.
(3)铝在空气中被氧气氧化,生成一层致密的氧化铝保护膜,阻止铝与稀盐酸反应;稀盐酸的溶质质量分数在反应中逐渐降低;
点评 本题难度不大,掌握有机合成材料的分类、化学方程式的书写方法是正确解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
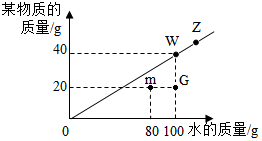 t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.请回答下列问题:
t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 加入物质 | 氢氧化钠溶液 | 氯化钡溶液 | 稀盐酸 |
| 现 象 | 固体溶解,产生无色气体 | 产生白色沉淀 | 固体溶解,无气体产生 |
| A. | Mg | B. | K2CO3 | C. | (NH4)2SO4 | D. | (NH4)2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | LiMnO2是氧化物 | B. | 该反应是化合反应 | ||
| C. | 此反应中,二氧化锰是催化剂 | D. | LiMnO2中锰元素的化合价显+2价 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 31 | 21 | 10 |
| 反应后的质量/g | m | 40 | 6 | 16 |
| A. | 甲一定是该反应的催化剂 | B. | 该反应一定是化合反应 | ||
| C. | 丙物质一定属于化合物 | D. | 乙、丁在反应中的质量比为5:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
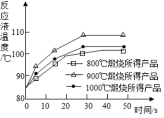
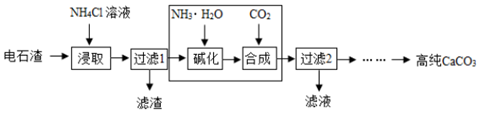
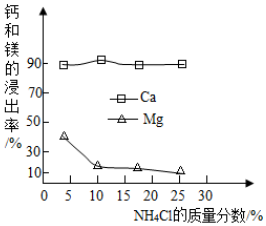
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com