
 某学习小组用如图装置测定铜锌合金中锌、铜的质量分数.
某学习小组用如图装置测定铜锌合金中锌、铜的质量分数.| a-b |
| a |
| a-b |
| a |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:初中化学 来源: 题型:
 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.查看答案和解析>>
科目:初中化学 来源: 题型:
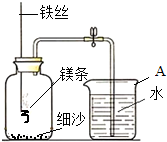 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的体积约占集气瓶体积的70%.请回答:
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的体积约占集气瓶体积的70%.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
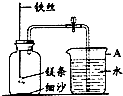 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%.| 3 | 4 |
查看答案和解析>>
科目:初中化学 来源:2011年北京市昌平区中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com