
【题目】在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲乙丙丁4种物质的质量分数,得到质量分数分布图分别如下:
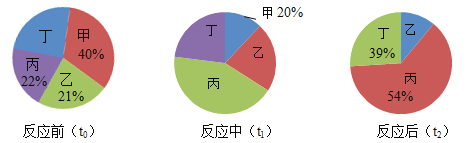
下列说法错误的是( )
A. 该反应中,乙是反应物,丁是生成物
B. t1时刻,甲和乙的质量比为5:7
C. 若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2:1
D. 若反应前物质总质量为100克,如果再增加20g甲,则甲与乙可恰好完全反应
【答案】BC
【解析】
由反应前(t0)可知,丁的质量分数=1-21%-22%-40%=17%。由反应后(t2)可知,乙的质量分数=1-54%-39%=7%,甲的质量分数为0。参加反应的甲、乙、丙、丁的质量比为40%:(21%-7%):(54%-22%):(39%-17%)=20:7:16:11。由图可知,甲、乙质量分数减小,属于反应物,丙、丁质量分数增大,属于生成物。
A、由分析知,该反应中,乙是反应物,丁是生成物,正确,不符合题意;
B、由图可知,t1时刻,甲反应了二分之一,故乙消耗的质量分数为(21%-7%)×![]() =7%,故t1时刻,甲和乙的质量比为20%:(21%-7%)=10:7,错误,符合题意;
=7%,故t1时刻,甲和乙的质量比为20%:(21%-7%)=10:7,错误,符合题意;
C、若为碳还原氧化铜,则 ,160:12≠20:7,质量比不符合;若为一氧化碳还原氧化铜,则
,160:12≠20:7,质量比不符合;若为一氧化碳还原氧化铜,则![]() ,80:28 =20:7,质量比符合要求。但此时甲、乙的化学计量数之比为1:1,错误,符合题意;
,80:28 =20:7,质量比符合要求。但此时甲、乙的化学计量数之比为1:1,错误,符合题意;
D、若反应前物质总质量为100克,则甲的质量为40g,乙的质量为21g,再增加20g甲,则反应前甲、乙质量比为(40g+20g):21g=20:7,所以甲与乙可恰好完全反应,正确,不符合题意。故选BC。


科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。图1为水厂生产自来水的流程示意图,回答下列问题:
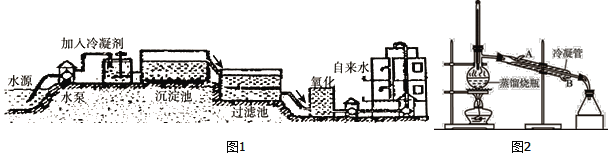
(1)在沉淀池和过滤池中发生的变化是______(填“物理”和“化学”)变化。
(2)过滤池是自来水生产过程中的重要环节,其中用到活性炭,在过滤过程中活性炭的作用是对水中的部分杂质进行______,除去水样中的色素和异味。
(3)实验室进行过滤操作时,下列做法不恰当的是______。
A 玻璃棒要靠在三层滤纸的一边
B 漏斗下端的管口要紧靠烧杯的内壁
C 液面不要低于滤纸边缘
D 滤纸的边缘要低于漏斗口
(4)净化后的水要转变为蒸馏水,可用如图2所示的制取蒸馏水的装置,在操作中经常需要在蒸馏烧瓶中加入碎瓷片,其作用是______,冷凝管中水应从______(填“A”或“B”)端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的日常生活和工农业生产离不开水。请回答:
(1)某地下水中含有较多可溶性钙、镁矿物质,该水属于____(填“软水”或“硬水”)。
(2)自然界中的水一般要净化后才能使用,在沉降、过滤、吸附蒸馏等净水方法中,单一操作相对净化程度最高的是_____。
(3)从海水中提炼出来的重水(化学式为D2O)中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为___________。
(4)下列关于水的说法中,不正确的是_____
A.水是由氢气和氧气组成
B.洗菜、洗衣后的水用来冲洗厕所
C.水通电分解时,水分子的能量没有发生变化
D.合理施用农药、化肥,以减少水体污染
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)有一包粉末,已知由CaCO3、FeCl3、MgCl2、Na2SO4、NaOH、NaNO3中的几种组成。为确定其组成,现进行以下实验,各步骤均已充分反应。
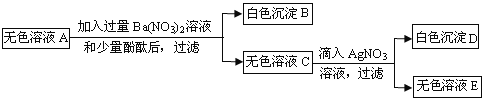
①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀盐酸,得到无色气体和黄色溶液;
③将①步得到的无色溶液A进行如下图所示的实验。
请回答下列问题:
(1)B的化学式是 。
(2)A中一定存在的溶质的化学式是 。
(3)生成白色沉淀D的化学方程式是 。
(4)这包粉末中可能含有物质的化学式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图所示,图中a、b、c、d分别表示相应物质的质量。下列说法正确的是( )
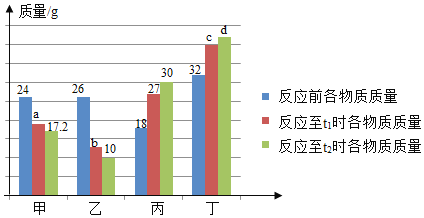
A. b的数值为14
B. 该反应为复分解反应
C. 反应过程中乙与丁发生改变的质量比为5:6
D. 充分反应后生成丙的质量为37.5g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在密闭容器内有氧气、二氧化碳、水蒸气和一种未知物质W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中正确的是( )
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为2
B. 该反应属于置换反应
C. 该反应中的二氧化碳和水蒸气的质量比为44:27
D. 该反应中物质W含碳元素的质量为10g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | ||||||
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是_____(填“A”或“B”).
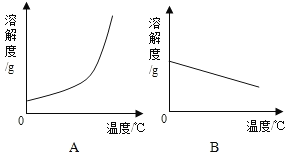
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有_____(填序号).
①蒸发水 ②升高温度 ③降低温度 ④加入水 ⑤加入氢氧化钙
(3)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20℃,得到乙溶液,溶液中溶质的质量分数的关系为甲_____乙(填“>”“<”或“=”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应关系的是
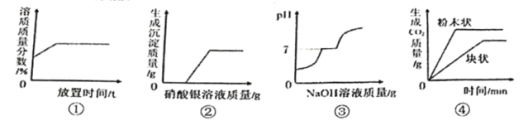
A.①浓硫酸敞口放置一段时间
B.②表示向一定量稀盐酸和氯化钡的混合液中滴加硝酸银溶液
C.③常温下向H2SO4、CuSO4混合溶液中滴加NaOH溶液
D.④表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜渣中约含![]() 7%、
7%、![]() 31%、
31%、![]() 50%、
50%、![]() 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如图所示(杂质不溶于水、不参与反应)。
5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如图所示(杂质不溶于水、不参与反应)。
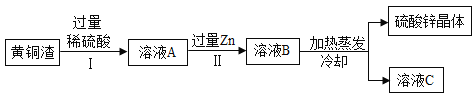
已知:![]() ;
;![]()
①Ⅱ中反应的化学方程式为________。
②下列说法正确的是________。
a Ⅰ、Ⅱ中的操作均包含过滤 b 溶液A中![]() 的质量大于
的质量大于![]()
c 溶液A的质量小于溶液B d 溶液C中溶质的质量分数小于溶液B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com