
【题目】甲、乙两种固体的溶解度曲线如下图所示,下列说法正确的是
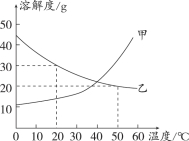
A.20℃时,甲溶液中溶质质量一定小于乙溶液
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,100 g水中加入20 g甲可得到饱和溶液
D.50℃时,100 g水中加入20 g乙并降温至20℃,溶液由不饱和变饱和
【答案】C
【解析】
试题分析:A、从溶解度曲线图可看出:在20℃时,乙的溶解度大于甲的溶解度,故可以说等质量的甲乙饱和溶液中,甲溶液中溶质质量一定小于乙溶液,如果没有讲明是否是等质量的饱和溶液,那无法比较,错误,B、从溶解度曲线图可看出:在20℃时,乙的溶解度为30g,表示的是在100g水中达到饱和状态溶解质量为30g,故此时溶质质量分数=30g/130g×100%=23.1%,无法达到30%,错误,C、由于20℃时,乙的溶解度小于20g,故20℃时,100 g水中加入20 g甲可得到饱和溶液,正确,D、鱼鱼乙的溶解度随温度的升高而降低,故50℃时,100 g水中加入20 g乙并降温至20℃,溶液由饱和变不饱和,错误,故选C


科目:初中化学 来源: 题型:
【题目】(4分)今年我市化学实验操作考试有三道考题:①探究酸和碱的化学性质;②CO2的制取和收集;③配制一定溶质质量分数的溶液。考试的方法是由考生抽签确定考题,某同学抽签后完成实验的主要操作过程如下图所示,请回答:

(1)图中仪器A的名称是 。
(2)该同学操作有误的是 (填序号)。
(3)在第一步操作中,当观察到 (填现象),说明气密性良好。
(4)该同学抽到的是第 题。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯碱工业中会发生下列化学反应:2X + 2H2O ![]() 2NaOH + H2↑ + Cl2 ↑,则X的化学式是 ,构成该物质的微粒符号是 。用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质HAuCl4(四氯合金酸),其中氯元素的化合价是--1,则金元素(Au)的化合价是 。
2NaOH + H2↑ + Cl2 ↑,则X的化学式是 ,构成该物质的微粒符号是 。用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质HAuCl4(四氯合金酸),其中氯元素的化合价是--1,则金元素(Au)的化合价是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)(1)某简单粒子的结构示意图可表示为:
当x=13时,写出该粒子的硫酸盐的化学式为: 。
(2)物质①牛奶②白醋③蔗糖④矿泉水,其中属于纯净物的是 (填序号)。②中滴入紫色的石蕊试液呈 色。
(3)如果用此装置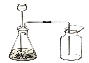 制取氧气,锥形瓶内所装固体为 (写化学式)。
制取氧气,锥形瓶内所装固体为 (写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)A-G和X都是初中化学中的常见物质,其中A、C、E是无色气体,B是红棕色固体,X为蓝色溶液,它们的转化关系如下图所示(部分反应物、生成物已省略):
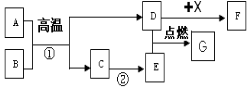
(1)G的化学式是 ;
(2)写出反应①的化学方程 ;
(3)写出在自然界普遍存在反应②,其名称为
(4)D与X充分反应后过滤后得滤渣F,在滤渣F中加入稀盐酸,有气泡产生,则滤渣的成分是 ____ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
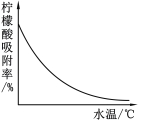
【题目】(8分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
④某种专用树脂对柠檬酸的吸附率和水温的关系如右图:
【钙盐法制备】
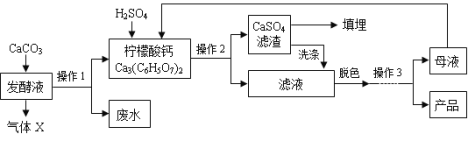
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭 B.明矾 C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;
【变温色谱分离法制备】
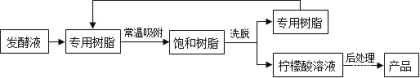
(7)对比“变温色谱分离法”,请你说出“钙盐法”的劣势 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)我国是铝生产大国,铝生产是以铝土矿为原料,经过纯制和电解过程生产而
成,以下是生产铝的主要工艺流程及工艺介绍。
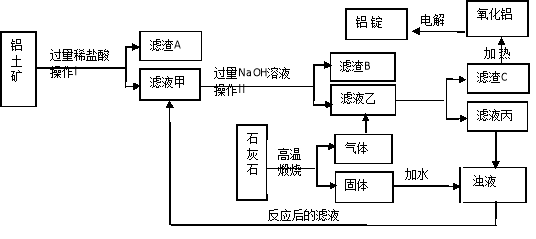
纯制工艺:就是先将铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质)分别用稀盐酸和氢氧化钠溶液溶解,去除杂质和获得偏铝酸钠溶液,然后向偏铝酸钠溶液中通入过量的CO2以便得到高纯度的Al(OH)3。
电解工艺:通电分解由Al(OH)3加热分解而成的Al2O3 。
根据以上图解和介绍,请回答下列相关问题:
(1)生产流程中的操作Ⅰ、Ⅱ名称是 。
(2)铝土矿中加入过量稀盐酸会发生多个反应,其中的一个反应的化学方程式是 。
(3)滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是: 4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、 2X+CO2+3H2O=2Al(OH)3↓+Na2CO3 这两个化学方程式中X的化学式为 。
(4)最终制得铝的化学方程式是 。
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)鸡蛋壳的主要成分是碳酸钙.小明同学为了测定鸡蛋壳中碳酸钙的质量分数,分别设计了如下实验并进行计算.将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应).
测得相关数据如图所示:

【数据处理】
(1)反应生成二氧化碳的质量为 g.
(2)请帮小明计算鸡蛋壳中碳酸钙的质量分数,并写出计算过程:
实验过程如果有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比 (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com