【答案】
分析:(1)在书写化学方程式时要根据质量守恒定律的实质.
(2)烧瓶的作用就是加热液体或者对液体进行蒸馏,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流而加了装置C.
(3)从实验所要达到的目的可以看出,前一个装置是完成第一步实验的,而后一个装置是完成第二步实验的.
(4)为了方便加入稀盐酸使用了长颈漏斗,由于盐酸具有挥发性,所以在生成氢气的同时也会带出一部分水蒸气和氯化氢.
(5)反应需要高温和水蒸气,故A和B都需要加热.
(6)氢气是可燃性气体,所以在做其性质实验时要保证氢气的纯度.
解答:解:(1)根据题干中所提供的物质可以推断出第一步实验中除了生成四氧化三铁外还会生成氢气,故本题的答案为:
3Fe+4H
2O
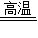
Fe
3O
4+4H
2 Fe
3O
4+4H
2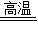
3Fe+4H
2O 上述两个反应中反应物都是一种单质和一种化合物,生成物是另一种单质和另一种化合物,都属于置换反应.
(2)烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,故本题的答案为:产生水蒸气;
(3)试管A是铁与水蒸气反应的装置,故在A中装的应该是普通铁粉,在反应过程中 要生成氢气,所以D是用来收集氢气的,故本题答案为:普通铁粉;H
2 (4)装置F是用来制取氢气的装置,所以装置E是用来添加盐酸的,由于使用的是稀盐酸来制取氢气,所以在产生氢气的同时可能带出部分水蒸气和氯化氢气体,故在U型管中加入氢氧化钠来干燥气体,故本题答案为:稀盐酸 除去氢气中的HCl气体,除去氢气中的水蒸气.
(5)反应是在高温的条件下反应的,所以A和H装置要加热,同时反应需要水蒸气的参加,故B也需要加热,故本题答案为:AB
(6)氢气是可燃性气体,所以在做氢气的性质实验时必须保证氢气是纯净的,未参加反应的氢气直接排入实验室中,可能引起爆炸故要点燃除去或用气球收集起来.故本题的答案为:检验氢气的纯度,点燃尾气或用气球收集
故答案为:(1)3Fe+4H
2O
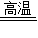
Fe
3O
4+4H
2 Fe
3O
4+4H
2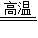
3Fe+4H
2O ①②
(2)产生水蒸气;
(3)普通铁粉;H
2(4)稀盐酸;除去氢气中的HCl气体,除去氢气中的水蒸气.
(5)A、B、
(6)验纯,点燃尾气
点评:我们在制取氢气时通常用的是稀硫酸,但是本题要求我们必须使用稀盐酸,故氢氧化钠的起了一箭双雕的作用,这点是我们做题时易错的地方,要多加注意,从这里可以看出,我们在做题时要克服思维定势,仔细审题以保证答题的准确性.


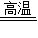 Fe3O4+4H2 Fe3O4+4H2
Fe3O4+4H2 Fe3O4+4H2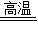 3Fe+4H2O 上述两个反应中反应物都是一种单质和一种化合物,生成物是另一种单质和另一种化合物,都属于置换反应.
3Fe+4H2O 上述两个反应中反应物都是一种单质和一种化合物,生成物是另一种单质和另一种化合物,都属于置换反应.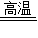 Fe3O4+4H2 Fe3O4+4H2
Fe3O4+4H2 Fe3O4+4H2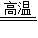 3Fe+4H2O ①②
3Fe+4H2O ①②

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案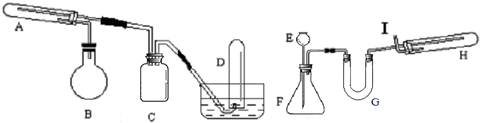
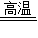 4Al2O3+9Fe 在此反应中,氧化剂是( )
4Al2O3+9Fe 在此反应中,氧化剂是( )