
【题目】下列变化属于化学变化的是( )
A.干冰升华
B.酒精挥发
C.铁钉锈蚀
D.石蜡熔化
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】向Mg(HCO3)2溶液中加入一定量NaOH溶液,出现白色沉淀.某同学经过过滤、洗涤、低温烘干得白色固体,并作如下探究: 【猜测】
白色固体可能是:①Mg(OH)2;②MgCO3;③Mg(OH)2、MgCO3混合物.
【资料】
MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物.
【实验1】
(1)取适量白色固体,溶于 , 出现(填现象),则猜测①不成立.
(2)另取适量白色固体,充分加热,产生的气体使无水CuSO4粉末变蓝,则猜测(选填“②”或“③”)成立. 有同学查阅资料得知上述固体应为碱式碳酸镁[xMgCO3yMg(OH)23H2O],其不溶于水,加热易分解.
(3)【实验2】 为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图(选填“甲”或“乙”)装置,测得生成气体的质量.
实验数据:
①加热后剩余固体质量1.60g;
②浓硫酸增重0.72g;
③浓NaOH溶液增重1.32g.
则:x:y= .
(4)【延伸】 将该碱式碳酸镁长期浸泡在浓NaOH溶液中,固体全部转化为Mg(OH)2 . 写出此反应的化学方程式 .
(5)工业上碱式碳酸镁可作阻燃剂,其可能的原因是(选填序号). a、分解时吸热,降低可燃物的着火点
b、生成的固体覆盖燃烧物,隔绝氧气
c、生成的气体稀释了可燃物周围的氧气浓度.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家发现用亚硝酸钠(Na2SeO3)能消除加速人体衰老的活性氧,亚硝酸钠中硒(Se)元素的化合价为( )
A.﹣2
B.+2
C.+4
D.+6
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO33H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究. 【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2 , 其水溶液具有Na2CO3和H2O2的双重性质;
Ⅱ.过碳酸钠与盐酸反应:2(2Na2CO33H2O2)+8HCl═8NaCl+4CO2↑+3O2↑+10H2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放处的“活性氧”有关,“活性氧”含量越高,去污能力越强.
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈(选填“酸性”、“中性”或“碱性”).
(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是 .
(3)过碳酸钠样品中“活性氧”含量可按如下公式计算: “活性氧”含量= ![]() ×100%
×100%
为测定某过碳酸钠样品中“活性氧”含量,取20g样品按如图实验装置与足量盐酸反应.(已知样品中杂质不溶于水且不与盐酸反应,装置气密性良好)
①将盐酸慢慢地入A中,反应一段时间,观察到 , 停止滴加盐酸.
②装置B可吸收生成的CO2 , 该反应的化学方程式是 .
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的 .
④将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量,写出其计算过程 .
⑤完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量.但丁同学认为该方案不合理,丁同学的理由是(填写一条即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化镁是一种重要的化工原料,同学们在实验室对其开展了系列研究.
(1)课题1:选择制取氯化镁的原料 【查阅资料】
①全球海水中含有的盐类总质量为5亿亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
离子 | Cl﹣ | Na+ | Mg2+ | Ca2+ | K+ | 其他 |
含量 | 55.06% | 30.61% | 3.69% | 1.15% | 1.10% | … |
②工业生产中海水或卤水(海水晒盐后的剩余溶液)都可以作为制取氯化镁的原料.
【交流讨论】
同学们经讨论,一致选择卤水用于实验室制取氯化镁.你认为他们的理由是 .
(2)课题2:由卤水制取氯化镁 同学们设计如图所示方案,从卤水中制取氯化镁.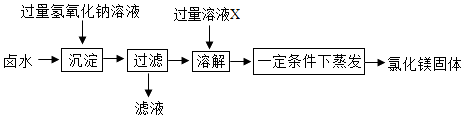
①溶液X的名称是 .
②部分同学认为上述制取方案不够完善,在“过滤”操作后缺少“洗涤”操作,从而导致制取的氯化镁不纯,可能混有的杂质是 .
(3)课题3:测定氯化镁产品的纯度(氯化镁的质量分数) 同学们设计如下实验方案对制得的氯化镁进行纯度测定.
【实验步骤】
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④…
⑤向所得溶液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07gmL﹣1),并 , 当观察到溶液恰好褪色且30s内红色不复现,停止加入稀硫酸;
⑥计算氯化镁样品的纯度.
(4)【问题讨论】 ①为计算出氯化镁样品的纯度,除上述数据外,实验还需测量的数据是 .
②若缺少步骤④,则会导致氯化镁纯度测定不准确,步骤④的操作是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com