
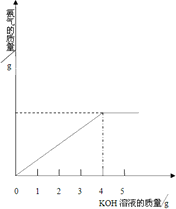
 硝酸铵中含有氮元素是农业生产中常用的氮肥,为测定某含有一定量KNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g28%的KOH溶液.发生如下反应:
硝酸铵中含有氮元素是农业生产中常用的氮肥,为测定某含有一定量KNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g28%的KOH溶液.发生如下反应: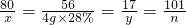
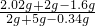 ×100%=36.3%
×100%=36.3%

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:初中化学 来源: 题型:
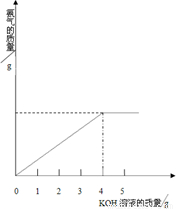
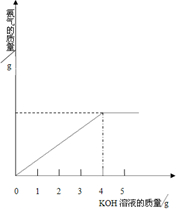 硝酸铵中含有氮元素是农业生产中常用的氮肥,为测定某含有一定量KNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g28%的KOH溶液.发生如下反应:
硝酸铵中含有氮元素是农业生产中常用的氮肥,为测定某含有一定量KNO3的硝酸铵样品中NH4NO3的纯度,取2.0g该硝酸铵样品于容器中,滴入5.0g28%的KOH溶液.发生如下反应:查看答案和解析>>
科目:初中化学 来源:湖南省湘西州龙山县普通初中第二届命题竞赛化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com