
【题目】镍粉常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
I、【镍粉制备】:
工业用电解镍新液(主要含NiSO4、NiCl2)制备碱式碳酸镍晶体xNiCO3·yNi(OH)2·zH2O,并利用其制备镍粉的流程如下:
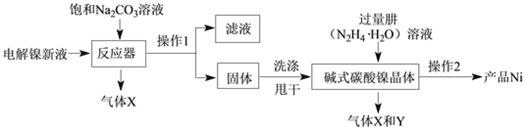
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,X的化学式为______。
(2)物料在反应器中反应时需要控制反应条件。
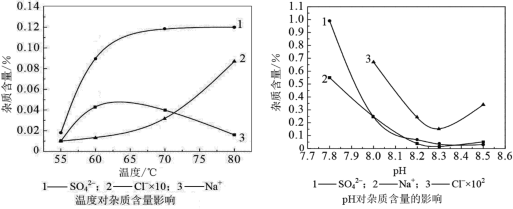
分析下图,反应器中最适合的温度及pH分别为______℃、______。
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将______(填“升高”、“降低”或“不变”)。
(4)操作1的名称是_______________,实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒及_________,其中玻璃棒的作用是_____。
(5)固体洗涤时,需用纯水洗涤,检验其洗涤干净的试剂是______。
(6)气体Y是空气中含量最多的气体,其是______(填名称)。
(7)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是______。
II、【测定碱式碳酸镍晶体的组成】:为测定碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)组成,某小组设计了如下实验方案及装置:
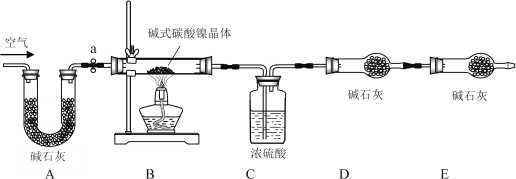
【资料卡片】:
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O。
②400℃左右,NiO会氧化生成Ni2O3。
③碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O。
【实验步骤】:
①______;②准确称取3.77g xNiCO3·yNi(OH)2·zH2O放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,称量装置C、D的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,______;⑥准确称量装置C、D的质量;⑦根据数据进行计算(相关数据如表)。
装置C / g | 装置D / g | 装置E / g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】:
(8)完善实验步骤中的填空:①______;⑤______。
(9)计算xNiCO3·yNi(OH)2·zH2O中x:y:z的值______。
(10)左侧通空气的目的是______、______。
【实验反思】:
(11)实验结束后,称得装置B中残留固体质量为2.33g。请通过计算确定残留固体的组成及各成分的质量(写出计算过程,精确到小数点后两位)_____。
【答案】 CO2 55 8.3 升高 过滤 漏斗 引流 BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液 氮气 便于快速晾干 检查装置气密性 缓缓通空气一段时间 1:2:4 排尽装置中原有的CO2和水蒸气 将装置B中的CO2和水蒸气完全排出 残留固体为NiO和Ni2O3的混合物,剩余NiO质量为1.5g,生成Ni2O3 0.83g
【解析】I、(1)根据质量守恒定律反应,前后原子的总类和数目不变,
3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,
反应前:Ni:3 反应后:Ni:3
S:3 S:3
O:23 O:17
H:4 H:4
C:3 C:1
所以X为:CO2
(2)反应器中杂质的含量越低越好,所以最适合的温度为55,最适合的pH为8.3;
(3)在NiCO3中镍的含量小于Ni(OH)2中镍的含量,生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,NiCO3的含量相对减小,则生成的碱式碳酸镍晶体中,镍的含量将升高。
(4)操作1将固体和液体分开,所以操作1为过滤,过滤过程中需要的玻璃仪器是烧杯、玻璃棒及漏斗,玻璃棒起到引流的作用;
(5)洗涤的目的是将碱式碳酸镍晶体表面的硫酸钠溶液等除去,检验其洗涤的是否干净,即检查是否有硫酸根离子,可加入BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液,观察是否生成不溶于硝酸的沉淀;
(6)空气中含量最多的气体是氮气;
(7)用95%酒精浸泡的目的是使固体表面的水分分散到酒精中,便于固体快速晾干;
II、(8)做有关气体的制取和性质实验前,应先检查装置的气密性,加热后,为了将碱式碳酸镍晶体受热会完全分解生成的CO2及H2O完全被装置C、D吸收,缓缓通一段时间除去水分和二氧化碳的空气;
(9)装置C增加的质量(1.08g)为生成水的质量,装置D增加的质量(0.44g)为生成二氧化碳的质量;所以NiO的质量为3.77g-1.08g-0.44g=2.25g
xNiCO3·yNi(OH)2·zH2O![]() (x+y)NiO+xCO2↑+(y+z)H2O
(x+y)NiO+xCO2↑+(y+z)H2O
75(x+y) 44x 18(y+z)
2.25g 0.44g 1.08g
所以![]() ,
, ![]() ,
, ![]() ,
,
解得:x:y:z=1:2:4
(10)实验开始前左侧通空气的目的是排尽装置中原有的CO2和水蒸气;实验完毕时左侧通空气的目的是将装置B中的CO2和水蒸气完全排出 ;
(11)NiCO3·2Ni(OH)2 ·4H2O ~ 3NiO ~ 3Ni ~ 3O
377 225 177 48
3.77g 2.25g 1.77g 0.48g
∵ 装置B中残留固体质量为2.33g
∴ 残留固体中O元素质量为2.33g – 1.77g = 0.56g ,大于0.48g
残留固体中Ni、O元素质量比为1.77g:0.56g = 177:56
而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物。
残留固体质量增加2.33g – 2.25g = 0.08g,是和NiO反应的O2质量
设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO + O2![]() 2Ni2O3
2Ni2O3
300 32 332
x 0.08g y
x=0.75g y=0.83g
剩余NiO质量为2.25g – 0.75g = 1.5g,生成Ni2O3 0.83g。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:
【题目】向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示.

(1)烧杯中的溶液一定属于饱和溶液的是__(填序号);
(2)图二能表示NaNO3溶解度曲线的是__(填“甲”或“乙”);
(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的__(填序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某学校化学课外学习小组设计的探究工业炼铁原理及产物验证的实验。实验 中所用氧化铁的质量为1Og,硬质玻璃管的质量为50g。

(1)B装置中反应的化学方程式是______________________;E装置中反应的化学方程式是____________________,该反应是___________(选填“吸”或“放”)热反应.
(2)从实验安全的角度考虑D瓶中应盛放的试剂是______________。
(3)F装置的作用是_____________、_________________。
(4)为探究E装置中黑色粉末的成分是什么,同学们将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引。当装置冷却后称得E装置中玻璃管和固体的总质量为59g.则剩余黑色固体中铁元素质量为______。根据上述实验数据处理得出产物中黑色因体的成分是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案的设计合理的是
选项 | 实验目的 | 实验方案 |
A | 除去粗盐中的泥沙 | 将粗盐溶解、蒸发 |
B | 区分羊毛和腈纶 | 取样,点燃,闻气味 |
C | 除去CaO中的CaCO3 | 加入适量的稀盐酸 |
D | 探究Hg和Ag的金属活动性 | 分别伸入稀硫酸,观察现象 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法错误的是
A. 用灼烧的方法能区别棉花和羊毛
B. 用适量的水能区分NH4NO3固体和NaOH固体
C. 用pH试纸不能区分肥皂水和食醋
D. 用饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中很多问题需要化学知识,下列认识不正确的是
A. 煤燃烧过程中产生的二氧化硫是引起温室效应的主要物质
B. 我国规定食盐中必须加碘,这里的“碘”是指碘元素
C. 研发可降解的塑料,减少“白色污染”
D. 在铁桶中用硫酸铜溶液和石灰水配制农药波尔多液会失效
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将 100g 碳酸钙高温煅烧一段时间后,冷却测得剩余固体质量为 78g,再向剩余固体中加入足量稀盐酸,充分反应后,理论上共产生二氧化碳的物质的量是( )
A. 0.2mol B. 0.5mol C. 0.78mol D. 1mol
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学方程式符合题意且书写正确的是
A. 用止酸剂Al(OH)3治疗胃酸过多:Al(OH)3+HCl→AlCl+3H2O
B. 除去CO中混有的CO2,通过灼热CuO:CO+CuO![]() Cu+CO2
Cu+CO2
C. 用氢氧化钠溶液吸收尾气中二氧化硫:2NaOH+SO2→Na2SO4+H2O
D. 用稀硫酸除铁锈:Fe2O3+3H2SO4→Fe2(SO4)3+3H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题(所选仪器装置,填写序号字母):
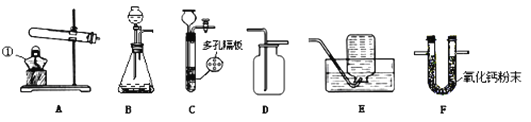
(Ⅰ)写出仪器①的名称:①_____________ 。
(Ⅱ)若用双氧水与二氧化锰为原料制取并收集一瓶干燥的氧气。则应选的气体发生装置为___,反应的化学方程式为______________;应选的气体干燥装置为________。
(Ⅲ)科技小组的同学对实验室制取CO2的实验条件展开了探究,探究实验如下表:
实验编号 | 反应物 | 反应现象 | |
① | 取mg块状大理石 | 足量的溶质质量分数为5%的盐酸 | 产生气泡较慢 |
② | 取mg大理石粉末 | 足量的溶质质量分数为5%的盐酸 | 产生气泡快 |
③ | 取mg块状大理石 | 足量的溶质质量分数为10%的盐酸 | 产生气泡较快 |
④ | 取mg大理石粉末 | 足量的溶质质量分数为10%的盐酸 | 产生气泡很快 |
实验结论:影响大理石和盐酸反应快慢的因素有______ 、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com