
【题目】锌是人体必需的的微量元素,称“生命元素”。
(1)【锌的广泛应用】
处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为。
(3)【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。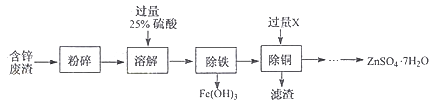
粉碎的目的是。
(4)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和 ,
(5)物质X是 , 滤渣中含有的金属单质有 ,
(6)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑过滤、洗涤和低温烘干。
(7)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
(8)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。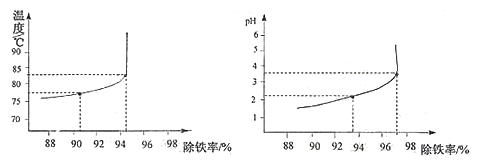
(9)【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验: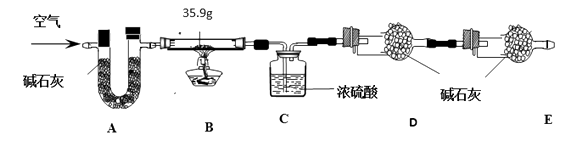
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ![]() ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ![]() ZnO+H2O。
ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
装置A的作用是。
(10)若没有E装置,测得二氧化碳的质量(填“偏大”、“偏小”或“无影响”)。
(11)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c = 。
(12)【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:。
【答案】
(1)侏儒,B
(2)Zn+H2SO4=ZnSO4+H2↑
(3)增大接触面积,使反应更快更充分
(4)22.7mL,胶头滴管
(5)Zn,Zn、Cu
(6)蒸发浓缩
(7)Fe3O4
(8)83±1,3.5±0.1
(9)除去空气中的CO2 和H2O
(10)偏大
(11)1∶2∶2
(12)ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑
【解析】解:(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。 缺乏严重时,将会导致“侏儒症”和智力发育不良。贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指元素;(2)锌与稀硫酸,生成硫酸锌和氢气。反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;(3)粉碎的目的是增大接触面积,使反应更快更充分;(4)用98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为x,则x×1.84g/ml×98%=200g×25%,x≈22.7ml; 需要的玻璃仪器有量筒﹑玻璃棒、烧杯和胶头滴管;(5)除铁后的溶液中含有硫酸铜和硫酸锌,要除掉铜,得硫酸锌溶液,所以加入的金属X是锌,滤渣中的金属有反应生成的铜和过量的锌;(6)要通过降温结晶得到七水硫酸锌,则应该先将溶液加热浓缩,然后再降温结晶;(7)设铁的氧化物的化学式为FexOy;56x/16y=21:8, x/y=3/4,所以氧化物为Fe3O4;除铁过程中,温度、pH对除铁效果的影响分别对如图所示。(8)由图可知,除铁时温度应控制在83±1 ℃为宜,pH应控制在3.5±0.1℃为宜;(9)装置A中碱石灰是氢氧化钠和氧化钙的混合物,能吸收水和二氧化碳,装置A的作用是除去空气中的CO2 和H2O ;(10)若没有E装置,D中的碱石灰能吸收空气中的水和二氧化碳,使测得二氧化碳的质量偏大;(11)装置C增加的量为水的质量,和装置D增加的为二氧化碳的质量,所以反应生成7.2 g水和4.4 g二氧化碳。aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2,据质量守恒定律可知反应前后物质的总质量不变,可知生成氧化锌的总质量为35.9g-7.2g-4.4g=24.3g;
设碳酸锌分解生成氧化锌的质量为x
ZnCO3 | ZnO+ | CO2↑ |
81 | 44 | |
x | 4.4g |
81/x=44/4.4g x=8.1g
则有氢氧化锌分解生成氧化锌的质量为24.3g-8.1g=16.2g,
设氢氧化锌分解生成水的质量为y
Zn(OH)2 | ZnO+ | H2O |
81 | 18 | |
16.2g | y |
81/16.2g=18/y , y=3.6g,
所以35.9g aZnCO3·bZn(OH)2·cH2O中结晶水的质量为7.2g-3.6g=3.6g,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =1:2:2;
所以答案是:(1)侏儒,B;(2)Zn+H2SO4=ZnSO4+H2↑;(3)增大接触面积,使反应更快更充分;(4)22.7ml;胶头滴管;(5)Zn;Zn、Cu;(6)蒸发浓缩;(7)Fe3O4;(8)83±1;3.5±0.1;(9)除去空气中的CO2 和H2O;(10)偏大;(11)1∶2∶2;(12)ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑。
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比.


科目:初中化学 来源: 题型:
【题目】下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式、。
(2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。
【查阅资料】
① NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;
② Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。
【实验验证】
① 将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 。
② 从实验二加热后的试管中分离出固体时,证明固体已洗涤干净的方法是。
③ 将②中所得固体溶于足量(选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
(3)【结论】猜想②正确。
【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】胃酸过多的人不宜大量食用的是( )
A.牛奶(pH:6.3-6.6)B.玉米粥(pH:7.1-8.0)
C.苏打水(pH:8.6-10.2)D.山楂汁(pH:2.1-2.8)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】形成化合物种类最多的元素是____________ ;钙、锌、铁、碘元素都属于人体必需的元素,其中属于常量元素的是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将金属铜进行如下实验:![]()
向得到的C溶液中逐滴滴加Ba(OH)2溶液,滴加Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。
请回答:
(1)写出Cu→A的化学方程式
(2)写出C溶液中溶质的化学式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com