
【题目】⑴请你判断下列化学式中的“2”分别表示下述哪种含义?
①表示离子的电荷数 ②表示微粒的数目 ③表示元素的化合价(填序号)2H______ ![]() ________________ Zn2+________
________________ Zn2+________
⑵判断下列物质的类别,并用相应的序号填空:
①单质 ②氧化物 ③酸 ④碱 ⑤盐
物质化学式 | P2O5 | Ca(OH)2 | H2CO3 |
物质类别 | _______ | _______ | _______ |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:
【题目】通过联想提出问题是探究的源泉,某合作学习小组开展了如下探究,请你协助他们完成:
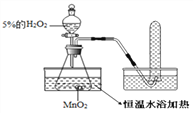
【提出问题】温度越高,分子运动越快;温度越高,化学反应也越快吗?
【实验探究】为了探究温度对H2O2分解反应速率的影响,某实验小组使用如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分数据如表所示:
实验1 | 实验2 | |
MnO2的质量/g | 0.5 | 0.5 |
5%的H2O2的体积 /mL | 40 | X |
恒温水浴加热/℃ | 40 | 80 |
收集一试管氧气所需要时间/ 秒 | 36 | 23 |
(1)实验2中X=____;
(2)在两次实验中,记录不同温度下收集同体积的氧气所需要时间的实验设计目的是______;还可以_______________________ 达到相同的目的,
【实验结论】通过两次实验的实验记录,你可以得出的实验结论是:_________________ ;
【实验拓展】请根据所学再举出一例与温度有关的实验结论:温度越高,_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
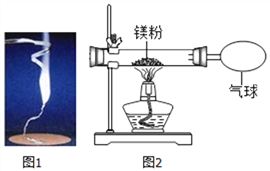
同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,因此镁在军事上作_________;
同时同学们还观察到产生的大量白烟弥漫到空气中,最后一些白色固体掉落在仪器A上。
(1)上述仪器A名称是____________。
(2)同学们通过称量发现:在仪器A上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________。
(3)小红按下图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁( Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论 |
_______________________ | ________________ |
【反思与交流】
①写出镁条燃烧生成氮化镁的化学方程式为____________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_________________;
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识:___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在硫酸与硫酸铜的混合溶液200g中,滴入40%的NaOH溶液100g,恰好完全反应,记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.

回答:
(1)与硫酸铜反应的氢氧化钠溶液的质量为__________g。
(2)此硫酸的溶质质量分数为________?
(3)反应后溶液溶质的质量分数是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊。
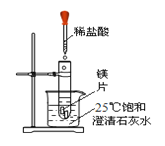
(一)石灰水变浑浊的原因是:
(1)镁和盐酸的反应________(填“吸热”或“放热”)。
(2)__________________。
(二)甲同学测得反应后试管内溶液pH<7 ,该溶液pH<7的可能原因是:
①MgCl2溶液的pH<7; ②______________________。
(三)乙同学将反应后试管内溶液冷却,加入镁粉并滴入酚酞,溶液颜色无变化,再加热,发现溶液慢慢浑浊且变红。
【猜想】对实验中“溶液慢慢浑浊且变红”的原因,乙同学提出猜想:
MgCl2+2H2O=Mg(OH)2↓+2HCl,大家都认为此猜想不合理,理由是___________。
【查阅】资料1:Mg(OH)2难溶解于水,升高温度可加大其在水中的溶解度。
资料2:K、Ca、Na、Mg等活泼金属在一定条件下能与水反应,产生碱和气体。
【实验】乙同学重新在滴有酚酞的热水中加入镁粉,观察到液体慢慢变红并浑浊,镁粉表面产生气泡。收集并点燃气体,发现能燃烧。乙同学实验中“溶液慢慢浑浊且变红”的原因请用化学方程式表示:_________________________。
(四)同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀。据文献介绍,碱式氯化镁的化学通式可表示为Mgx(OH)yClz,其不溶于水,能与酸反应。
(1)做镁与稀盐酸反应的实验时,镁条的用量宜少不宜多。
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活动性比铜_____(填“强”或“弱”),还可根据铁和硫酸铜溶液的反应来确定这两种金属的活动性强弱,该反应的化学方程式为_______,该反应的基本类型是______。
(3)取一定量的碱式氯化镁沉淀【Mgx(OH)yClz】,溶于稀硝酸,将所得溶液分成两等份。
①向一份溶液中滴加过量的NaOH溶液,生成了1.74gMg ( OH )2沉淀;
②向另一份溶液中滴加过量的AgNO3溶液,生成了5.74 g沉淀。
通过计算得知:x:z=____________,所得碱式氯化镁的化学式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的FeO、CuO。工艺流程图如下:(假设每一步骤反应均完全)

⑴为提高矿石的溶解速度,操作1是___________ 。
⑵菱锌矿溶解后所得的溶液中金属阳离子有_____________种。
⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,写出反应1中生成Fe2(SO4)3的化学方程式___________________________。
⑷结晶之前,溶液中除了硫酸锌,还一定存在的溶质是_________________。
⑸硫酸锌晶体的溶解度曲线如下图所示,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为____________________。

⑹流程中还可能得到一种紫罗兰色晶体(NH4)xFey(SO4)z·7H2O。已知该化合物中氮、铁元素质量比为1:4,则x:y :z=________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用和相应的化学方程式都正确的是
A. 高炉炼铁发生的主要反应:2Fe2O3+3C高温4Fe+3CO2↑
B. 用生石灰处理硫酸厂废液:Ca(OH)2+H2SO4=CaSO4+2H2O
C. 用硝酸银溶液鉴别海水和蒸馏水:AgNO3+NaCl=AgCl↓+NaNO3
D. 用稀盐酸鉴别黄铜和黄金:Cu + 2HCl = CuCl 2 + H2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题.
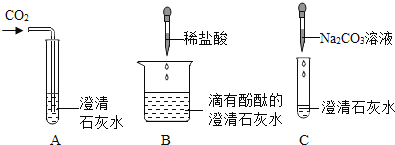
(1)实验A中,一定能够观察到的明显现象是________;
(2)实验B验证了氢氧化钙能跟酸、_______作用;
(3)实验C中发生的反应可用化学方程式表示为_______________;
(4)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液。生成沉淀的质量与所用氢氧化钠溶液的质量关系下图所示。已知:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓。
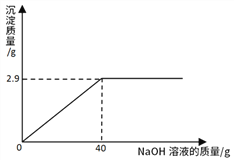
(1)配制40g溶质质量分数为10%的NaOH溶液,需NaOH的质量=_______g。
(2)计算MgSO4溶液中溶质的质量分数为________________(列式计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com