
分析 根据质量守恒定律可知,反应前后固体的质量之差为氧气的质量,然后将氧气的质量代入化学反应方程式来计算氯化钾的质量及二氧化锰的质量,进而计算二氧化锰的质量分数.
解答 解:(1)由质量守恒定律可知,生成氧气的质量为:15.5g-10.7g=4.8g;
(2)设生成氯化钾的质量为x
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 4.8g
$\frac{245}{x}$=$\frac{96}{4.8g}$
x=12.25g
所以剩余固体中MnO2的质量为15.5g-12.25g=2.25g,因为催化加在化学反应前后质量不变,所以剩余固体中二氧化锰的质量分数为$\frac{2.25g}{10.7g}$×100%=21.0%.
故答案为:(1)4.8;
(2)21.0%.
点评 根据质量守恒定律,由反应前后固体物质质量差即反应所产生氧气的质量;利用二氧化锰为反应的催化剂,反应前后质量不变,由混合物质量与参加反应的氯酸钾质量差可求得二氧化锰的质量.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 应及时回收废旧金属 | B. | 应禁止开采金属矿物 | ||
| C. | 应严禁使用金属材料 | D. | 应大力寻找并开采金属矿物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “碳海绵”是一种化合物 | |
| B. | “碳海绵”具有较强的吸附作用 | |
| C. | “碳海绵”在一定条件下可与氧化铜发生反应 | |
| D. | “碳海绵”在氧气中完全燃烧的产物是CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
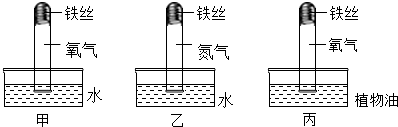
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是某胃药标签上的部分内容.某中学化学兴趣小组的同学们测定该药品中碳酸氢钠(NaHCO3)的质量分数,取10片该药品研碎后放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水,也不参加反应),共消耗稀盐酸23g.测得反应后烧杯内物质的总质量为25.8g.请计算:
如图是某胃药标签上的部分内容.某中学化学兴趣小组的同学们测定该药品中碳酸氢钠(NaHCO3)的质量分数,取10片该药品研碎后放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水,也不参加反应),共消耗稀盐酸23g.测得反应后烧杯内物质的总质量为25.8g.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
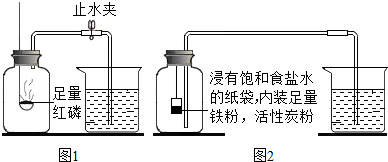
| 测量项目 | 实验前 | 实验后 | |
| 集气瓶(扣除内容物)和导管的容积 | 烧杯中剩余水的体积 | 烧杯中剩余水的体积 | |
| 体积/mL | 126.0 | 80.0 | 54.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com