【答案】
分析:水垢的主要成分是碳酸钙,碳酸钙能和盐酸反应生成氯化钙、水和二氧化碳.碳酸氢镁受热容易分解生成碳酸镁、水和二氧化碳.根据反应的化学方程式可以计算出相等质量的碳酸钠和碳酸氢钠通过加热、与盐酸反应生成的二氧化碳的质量.根据反应物和生成物及其质量守恒定律可以判断反应类型、相对分子质量等.浓盐酸易挥发,浓硫酸能吸水,可以作干燥剂.根据物质和所含有的杂质的性质方面分析、判断,从而找出除去杂质的正确方法.
解答:解:(1)根据上述信息可知,水垢的主要成分是碳酸钙.故填:CaCO
3(或碳酸钙).
碳酸钙能和盐酸反应生成氯化钙、水和二氧化碳,所以可以用稀盐酸除去水垢.
反应的化学方程式为:CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O.
(2)碳酸氢镁受热容易分解生成碳酸镁、水和二氧化碳.可以用加热的方法除去碳酸镁中的碳酸氢镁,反应的化学方程式为:
Mg(HCO
3)
2
MgCO
3+H
2O+CO
2↑.
(3)碳酸钠中碳元素的质量分数为:

×100%=11.3%.
碳酸氢钠中碳元素的质量分数为:

×100%=14.3%.
因为通过以上反应碳元素完全转化成了二氧化碳,所以碳酸氢钠生成的二氧化碳多.故填:不相等.
(4)①由表中数据可知,X是生成物,生成了3.6g,Z是反应物,反应了33.6g,Q是生成物,生成了8.8g,根据质量守恒定律可知,Y是生成物,生成的Y的质量为:33.6g-3.6g-8.8g=21.2g,Y的数值为:21.2+4.6=25.8.故填:25.8.
②根据分析可知,反应物是一种,生成物是三种,属于分解反应.故填:分解反应.
③因为X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则有二氧化碳和Y的化学计量数之比为1:1,二氧化碳的质量是8.8g,Y的质量是21.2g,
设Y的相对分子质量为m,根据化学方程式有:
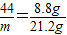
,解得:m=106.故填:106.
(5)浓盐酸易挥发,能够挥发出氯化氢气体.故填:HCl;挥发.
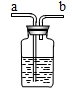
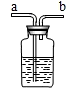
①不纯气体应从a端通入.故填a.
②浓硫酸能吸收水,可以作干燥剂.故填:浓硫酸.
③饱和的碳酸氢钠溶液可以除去氯化氢气体,反应的化学方程式为:NaHCO
3+HCl═NaCl+H
2O+CO
2↑.
点评:解答本题的关键是要掌握化学方程式的书写方法、根据化学方程式进行相关方面的计算方法、除去杂质的方法等方面的知识,只有这样才能对问题做出正确的判断.

 MgCO3+H2O+CO2↑.
MgCO3+H2O+CO2↑. ×100%=11.3%.
×100%=11.3%. ×100%=14.3%.
×100%=14.3%.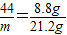 ,解得:m=106.故填:106.
,解得:m=106.故填:106.