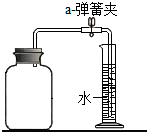
解:(1)铜丝在加热条件下可与氧气反应,所以注射器内减少的体积即为氧气的体积,可用于测定空气中氧气含量;反应完毕注射器内还有剩余的不与铜反应的气体,从而说明空气中物质不只一种,是混合物;
(2)铜和氧气在加热条件下生成氧化铜,方程式是:2Cu+O
2
2CuO,铜是红色、氧化铜是黑色,所以铜由红色变为黑色;
(3)空气中氧气约占空气总体积的五分之一,所以剩余气体约占空气总体积的五分之四,即30mL×

=24mL;作此实验,若实验结果差别较大,可能是装置的气密性不好,铜丝量不足,反应不充分等原因造成的;
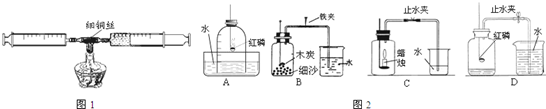
(4)要测定空气中氧气含量,所用可燃物要能与空气中氧气反应,且不生成气体;AD中红磷燃烧消耗氧气,生成五氧化二磷固体,进入水的体积就是减少的氧气的体积;B木炭,C蜡烛燃烧消耗氧气但生成二氧化碳气体,使瓶内气压变化不大,不能测定氧气的体积;
故答案为:(1)加热时引起与铜反应而消耗,减少的体积即为氧气的体积;反应后余下不与铜反应的气体,说明空气中含有性质不同的物质为混合物;
(2)红;黑;2Cu+O
2
2CuO;
(3)24;所用铜丝量不足(或装置漏气等合理均可);
(4)AD.
分析:(1)依据铜在加热条件下可与氧气反应,反应完毕注射器内还有剩余的不与铜反应的气体分析解答;
(2)依据铜是红色、氧化铜是黑色,及铜与氧气的反应原理分析回答;
(3)依据空气中氧气约占空气总体积的五分之一,及实验中测定的数据要受多种因素影响,如装置的气密性必须好,铜丝量要足等进行分析回答;
(4)用来测定空气中氧气含量的方法很多,常用方法是据可燃物消耗空气中的氧气,进入水的体积即是反应的氧气的体积,据此分析解答.
点评:本题考查测定空气中氧气体积分数药品选择、实验原理、误差分析以及实验方案的评价.解答时要熟悉实验原理,并能对实验产生失败的原意从反应物的选择、生成物的状态等粉末做出正确的分析和判断.

 2CuO,铜是红色、氧化铜是黑色,所以铜由红色变为黑色;
2CuO,铜是红色、氧化铜是黑色,所以铜由红色变为黑色; =24mL;作此实验,若实验结果差别较大,可能是装置的气密性不好,铜丝量不足,反应不充分等原因造成的;
=24mL;作此实验,若实验结果差别较大,可能是装置的气密性不好,铜丝量不足,反应不充分等原因造成的; 2CuO;
2CuO;

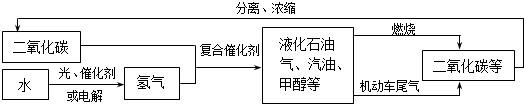
 请回答下列问题:
请回答下列问题: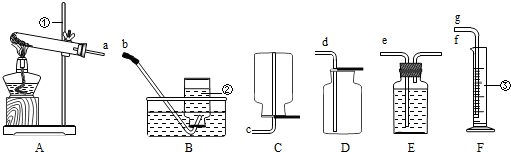
 甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究.
甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究. 用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察
用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察