
【题目】下列各组中的物质充分混合后,所得溶液的质量比反应前溶液的总质量减少的是( )
A.二氧化硫和氢氧化钠溶液
B.氢氧化钠固体与稀硫酸
C.铁和硫酸铜溶液
D.氯化钠溶液和稀盐酸
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】燃烧是一种普遍存在的化学反应现象.
(1)若要可燃物在空气中燃烧,还需要的条件是________.
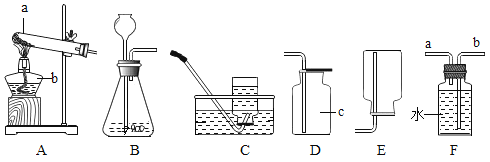
(2)某研究性学习小组欲利用下列装置进行氢气制取的探究,请回答下列问题.
①实验室制常用锌粒和稀硫酸反应来取氢气,写出其反应的化学方程式______.应选择的气体发生装置和收集装置是________.若用盛满水的F装置收集氧气,应从导管______(填a或b)通入.
②氢气是目前公认的最清洁的燃料,但现阶段还不能广泛使用的原因是什么?______
③为了安全起见,在点燃可燃性气体前,应该进行什么样的实验?______
(3)酒精是一种可再生能源,请写出其完全燃烧的化学方程式_______.
(4)天然气的主要成分是甲烷(CH4),它是一种“清洁能源”.甲烷在空气中完全燃烧生成二氧化碳和水,燃烧32g甲烷,可释放______克二氧化碳?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废科(含铝、锌、铜)进行如下实验:(提示:铝能与氢氧化钠溶液反应,使铝溶解,而其他金属不能溶解)
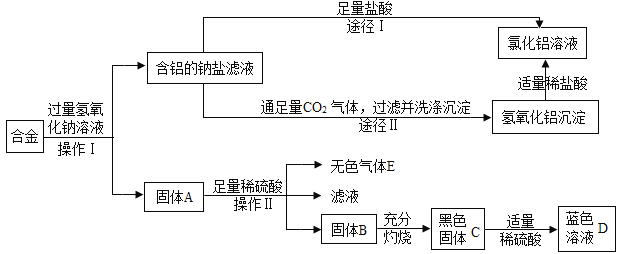
(1)操作Ⅰ的名称是_____________________;
(2)固体A的成分是_______________;操作Ⅱ反应的化学方程式为_________________。
(3)黑色固体C加适量释硫酸反应的方程式为_________________________。
(4)图中由含铝的钠盐制备氯化铝有兩种途径,你认为合理的途径是____________ (填:“Ⅰ”或“Ⅱ”)。理由是____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学世界神奇“多变”,在学习常见的盐的化学性质后,某化学兴趣学习小组完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程。
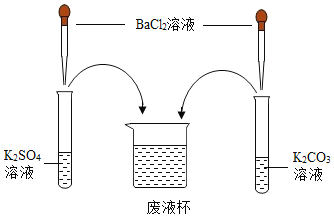
(提出问题)上层清液中含有什么溶质?
(作出猜想)Ⅰ、溶质仅为____________;
Ⅱ、溶质为 KCl 和 BaCl2;
Ⅲ、溶质为KCl 和____________________;
Ⅳ、溶质为KCl 和 K2CO3;
Ⅴ、溶质为 KCl、K2SO4 和 K2CO3。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液杯中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加 少量的_____________溶液 | 有白色沉淀产生 | 猜想Ⅰ、Ⅱ 均不正确 |
再向乙试管中滴加适量稀盐酸 | _________ | 猜想Ⅲ 不正确 | |
(继续探究)小花同学最终通过以下实验确定Ⅴ正确。实验方案如下:直接对上述甲试管实验后的悬浊液进行过滤,取少量滤渣于另一支试管中,__________(请将操作、现象补充完整)。
(交流反思)学习小组经讨论认为:实验过程中无须检验 KCl,其理由是_________(请用文字表述)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现提供下列装置回答有关问题:

(1)写出仪器 I 的名称:______。
(2)实验室需要配制50 g 10﹪NaOH 溶液。
①图A的称量操作有两处错误,请改正错误:_______ ;________。
②溶解后,装瓶时,需要用玻璃棒的目的是__________。
③贴标签:在标签上注明“_________ ”的字样
(3)选择仪器 B~J 完成下列实验操作:
①实验室用高锰酸钾制取纯净的O2,应选择的发生装置和收集装置的组合是_(填字母),其化学方程式为__。
②用C和G组合制取二氧化碳气体的发生装置比用C和F的组合的发生装置优点是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
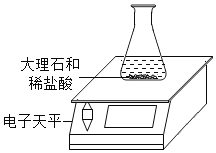
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知在一定条件下,能发生反应:![]() ,则下列说法中不正确的是( )
,则下列说法中不正确的是( )
A.若M、N、P、Q都是由分子构成的物质,则该反应前后分子数目一定不变
B.若Q为水,则该反应可能是氢氧化镁与硫酸的反应
C.若M、N、P、Q均为化合物,该反应不一定是复分解反应
D.若恰好完全反应后,生成32gP和32gQ,则P、Q的相对分子质量之比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家侯德榜创立候氏制碱法为纯碱和化肥工业的发展做出了杰出贡献,图1是候氏制碱法的反应原理,图2是相关物质的溶解度曲线,下列说法正确的是

A.该过程中除水外,能够循环利用的物质是氨气
B.制碱过程中首先析出的是碳酸氢钠,因为相同条件下,它的溶解度小于氯化铵
C.50℃时,向50g水中加入30g氯化铵充分搅拌,所得溶液为不饱和溶液
D.侯氏制碱法保留了氨碱法的优点,减少了环境污染,提高了原料利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com