
分析 (1)根据化学反应方程式中氢气的质量计算硫酸的质量分数;
(2)根据反应的情况计算硫酸锌的质量,而后利用溶质的质量分数计算方法计算即可;
(3)根据化学方程式计算生成的硫酸锌的质量,然后根据质量守恒定律计算反应后溶液的质量,结合溶解度的定义进行计算.
解答 解:设反应的硫酸的质量是x,生成硫酸锌的质量是y,反应的锌的质量是z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
z x y 0.2g
$\frac{65}{z}$=$\frac{98}{x}$=$\frac{161}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=9.8g
z=16.1g
(1)硫酸溶液中溶质的质量分数为:$\frac{9.8g}{100g}$×100%100%=9.8%;
(2)反应后所得硫酸锌溶液中溶质的质量分数=$\frac{16.1g}{6.5g+100g-0.2g}$×100%=15.1%;
(3)设该温度时硫酸锌的溶解度为n,则
$\frac{n}{100g}$=$\frac{16.1g}{100g+6.5g-0.2g-16.1g-40.2g}$
解答n=32.2g.
答:(1)硫酸溶液中溶质的质量分数为9.8%;
(2)反应后所得硫酸锌溶液中溶质的质量分数为15.1%;
(3)该温度时硫酸锌的溶解度为32.2g.
故答案为:(1)9.8%;
(2)15.1%;
(3)32.2.
点评 本题是关于化学方程式和溶液相关的计算考查题,解题的关键是能够对相关的计算原理的理解和掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:选择题
| A、化学与生活 | B、化学与环境 |
| ①生活中常用加热煮沸的方法软化硬水 ②干冰用于人工降雨 ③农业上熟石灰不能和氯化铵同时施用 | ①焚烧植物秸杆会造成空气污染 ②PM2.5是造成雾霾天气的元凶之一 ③保护金属资源只能通过防止金属腐蚀实现 |
| C、化学与安全 | D、化学与健康 |
| ①在室内放一盆水,可防止煤气中毒 ②夜间发现液化气泄漏开灯寻找泄漏源 ③煤矿井下严禁烟火 | ①人体缺铁会引起贫血 ②用甲醛的水溶液浸泡海产品保鲜 ③过量食用加碘食盐会引起甲状腺肿大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
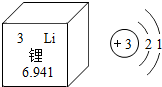 有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.
有“锂”走遍天下.锂电池广泛用于通信、电动车等行业,如图是锂的原子结构示意图和元素周期表中锂元素的部分信息,由此判断,锂原子在化学反应中易失去(选填“得到”或“失去”)电子,写出锂离子的符号Li+,氧化锂的化学式Li2O,氢氧化锂与盐酸反应是化学方程式LiOH+HCl═LiCl+H2O.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图).疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.使用一包该疏通剂,当铝与氢氧化钠溶液反应后,溶液中剩余氢氧化钠的质量是120克,请说明剩余氢氧化钠的用途和原理:中和酸性废水,NaOH+HCl=NaCl+H2O.
某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图).疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.使用一包该疏通剂,当铝与氢氧化钠溶液反应后,溶液中剩余氢氧化钠的质量是120克,请说明剩余氢氧化钠的用途和原理:中和酸性废水,NaOH+HCl=NaCl+H2O.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学与生活息息相关,可以帮助人类认识、改造世界.
化学与生活息息相关,可以帮助人类认识、改造世界.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电视机着火时用水浇灭 | |
| B. | 进入久未开启的菜窖用手电筒照明 | |
| C. | 用钢丝刷擦洗铝锅上的污垢 | |
| D. | 厨房天然气泄漏,立即关闭阀门并轻轻开窗通风 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:
如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com