
| A. | 石灰石粉末 | B. | 生灰石粉末 | C. | 澄清的石灰水 | D. | 硝酸银溶液 |
分析 根据将含有盐酸的氯化钙溶液由酸性调至中性,也就是除去盐酸,可选碱或碳酸盐,但是在选择时因不用指示剂,所以必须自己能控制溶液的酸碱性进行分析.
解答 解:A、石灰石不溶于水,只溶于酸,跟盐酸反应生成氯化钙、水和二氧化碳,所以加稍过量的石灰石能除去盐酸且溶液显中性,故A正确;
B、生石灰与水反应生成熟石灰,熟石灰和盐酸反应生成氯化钙和水,不引进新的杂质,但因没有指示剂,所以加稍过量的溶液显碱性,故B错误;
C、澄清的石灰水能与盐酸反应,生成氯化钙和水,不引进新的杂质,但因没有指示剂,所以加稍过量的溶液显碱性,故C错误;
D、硝酸银与两种物质均反应,反应后的溶液显酸性,不选.
故选:A.
点评 在除杂质时,所选的药品只能跟杂质反应,不能跟主物质反应,且不能引进新的杂质.同时在没有指示剂时,控制溶液的酸碱性也是要考虑的因素.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
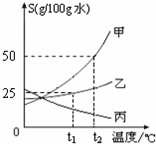 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe Cu MgCl2溶液 | B. | Mg Cu FeCl2溶液 | ||
| C. | Cu FeCl2溶液 MgCl2溶液 | D. | Mg CuCl2溶液 FeCl2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若向滤渣A中滴加稀盐酸有气泡生成,则滤渣A中一定含有Ag | |
| B. | 若向滤渣A中滴加稀盐酸无气泡生成,则滤液B中可能含有Cu2+ | |
| C. | 若向滤液B中滴加稀盐酸产生白色沉淀,则滤液B中可能含有Fe2+ | |
| D. | 若向滤液B中滴加稀盐酸无明显变化,则滤渣A中一定含有Ag,可能含有Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com