某工厂每天产生浓度为0.49%的废H2SO4溶液1×106g,需要用碱溶液中和处理.试计算:
(1)该厂每天要处理的废酸液中含有H2SO4______g,是______mol H2SO4.
(2)若用烧碱处理废酸液,每天需要NaOH______mol.
(3)若改用熟石灰处理废酸液,则每天需要Ca(OH)2的物质的量______NaOH的物质的量(填“大于”、“小于”或“等于”).
解:(1)每天要处理的废酸液中含有H
2SO
4的质量=1×10
6g×0.49%=4900g;
每天的处理废水中H
2SO
4的物质的量=
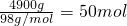
;
故答案为:4900;50;
(2)根据反应的化学方程式2NaOH+H
2SO
4=Na
2SO
4+2H
2O,可知NaOH与H
2SO
4反应的物质的量之比为2:1,
则需要NaOH物质的量=2×50mol=100mol;
故答案为:100;
(3)根据Ca(OH)
2+H
2SO
4=CaSO
4+2H
2O,可知Ca(OH)
2与H
2SO
4反应的物质的量之比为1:1,小于NaOH与H
2SO
4反应的物质的量之比(2:1),则每天需要Ca(OH)
2的物质的量小于NaOH的物质的量.
故答案为:小于.
分析:(1)利用溶质质量=溶液质量×溶液的溶质质量分数,计算每天要处理的废酸中硫酸的质量;再使用n=

求得硫酸的物质的量;
(2)根据反应的化学方程式,判断氢氧化钠与硫酸反应时两物质的物质的量的比,然后根据硫酸的物质的量计算需要氢氧化钠的物质的量;
(3)根据反应的化学方程式,判断使用氢氧化钙时氢氧化钙与硫酸的物质的量的比,与使用氢氧化钠反应时进行对比,判断每天需要两种碱物质的量的大小关系.
点评:利用反应的化学方程式可以表示反应中各物质的量的关系,可根据一种物质的量而求得反应中其它物质的量.

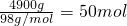 ;
; 求得硫酸的物质的量;
求得硫酸的物质的量;
