解:(1)方法Ⅰ:碳酸钙在900℃时能分解生成氧化钙和二氧化碳,方程式是CaCO
3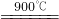
CaO+CO
2↑;
方法Ⅱ:①烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分提高反应速率,促进反应的进行;
②图2a中发生的反应是氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式是:CaO+H
2O═Ca(OH)
2、Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH,使用方法Ⅱ反应炉内要加热到900℃,消耗的能源太多,成本太大;
(2)①铅蓄电池充电时将电能转化为化学能储存起来,放电时是将化学能转化为电能释放出来;
②根据稀释前后溶质质量不变的原理进行计算;
设需要98%的浓硫酸的体积为x
(400ml×1.3g/cm
3)×40%=(x×1.84 g/cm
3)×98%
x≈115.4ml
需要水的质量为:(400ml×1.3g/cm
3)-(115.4ml×1.84 g/cm
3)≈307.7g,则水的体积为=

=307.7mL;
故答案为:(1)方法Ⅰ、CaCO
3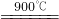
CaO+CO
2↑;
方法Ⅱ、①增大反应物的接触面积(或提高反应速率、提高吸收速率等合理均可);
②CaO+H
2O═Ca(OH)
2;Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH;能耗太大;
(2)①化学;电;②115.4;307.7.
分析:(1)根据题干提供的信息进行分析,反应器中碳酸钙在900℃时能分解生成氧化钙和二氧化碳;NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分,或提高反应速率等;图2a中发生的反应是氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;使用方法Ⅱ吸收二氧化碳消耗的能源太多;
(2)根据能量转化的知识判断;并根据溶液稀释前后溶质质量不变进行计算.
点评:本题能很好考查学生分析所给信息,并结合相关知识解决问题的能力,解答时可以依据已有的知识结合二氧化碳的性质,以及溶液的稀释进行解答,要细心分析、计算才能得出正确答案.


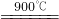 CaO+CO2↑;
CaO+CO2↑; =307.7mL;
=307.7mL;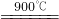 CaO+CO2↑;
CaO+CO2↑;

 阅读快车系列答案
阅读快车系列答案 (2013?海门市二模) 关注碳排放.
(2013?海门市二模) 关注碳排放.