
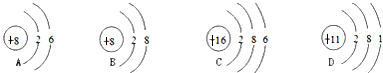
 2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应;
2H2↑+O2↑属于分解反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,故NaOH+HCl=NaCl+H2O属于复分解反应; 2H2↑+O2↑;NaOH+HCl=NaCl+H2O;
2H2↑+O2↑;NaOH+HCl=NaCl+H2O;

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
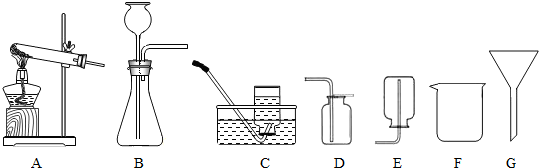
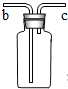
| 实验步骤 | 实验现象 | 结论 |
| 在常温常压下二氧化碳气体能溶于水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
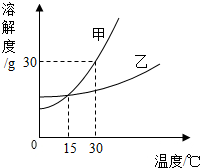 (2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
(2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:| 试管编号 | 加入液体 | 加入物质 | 现象 |
| 1 | 10mL水 | 少量食盐 | 不溶 |
| 2 | 10mL乙醇 | 少量食盐 | 溶解 |
| 3 | 10mL水 | 几小粒碘 | 不溶 |
| 4 | 10mL乙醇 | 几小粒碘 | 溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
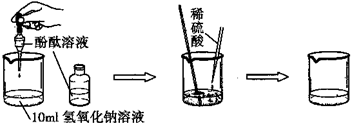
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:| 试管编号 | 加入液体 | 加入物质 | 现象 |
| 1 | 10mL水 | 少量食盐 | 不溶 |
| 2 | 10mL乙醇 | 少量食盐 | 溶解 |
| 3 | 10mL水 | 几小粒碘 | 不溶 |
| 4 | 10mL乙醇 | 几小粒碘 | 溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com