
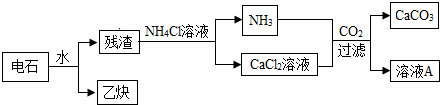
分析 (1)根据质量守恒定律写出反应物和生成物及方程式;
(2)根据流程判断反应前后质量没有发生变化的物质;
(3)根据信息分析反应的生成物进行解答;
(4)根据信息分析电石的保存方法.
解答 解:(1)根据质量守恒定律化学反应前后元素的种类不变可知乙炔(C2H2)完全燃烧产生二氧化碳和水,故反应的方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O; 故填:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O;
(2)由流程图可以看出,氯化铵和残渣反应产生氨气和氯化钙,氨气、二氧化碳和氯化钙和水反应生成碳酸钙和氯化铵,因此可以循环使用的物质是氯化铵,故填:NH4Cl;
(3)根据信息电石和水反应会产生氢氧化钙,氢氧化钙会继续吸收二氧化碳产生碳酸钙沉淀,因此电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是碳酸钙;故填:CaCO3;
(4)因电石极易与水反应,故应密封保存.故填:密封.
点评 本题属于信息题的考查,综合考查了产物的判断、化学方程式的书写,锻炼了学生的逻辑思维和分析解决问题的能力.


科目:初中化学 来源: 题型:选择题
 如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | t1℃时等质量甲、乙两种物质的饱和溶液中溶质质量相等 | |
| C. | 氧气的溶解度随温度变化的规律与图中的甲相似 | |
| D. | t2℃时等质量的甲、乙两物质的饱和溶液降温至t1℃时,两溶液中溶质质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,向浓硫酸中加水 | |
| B. | 点燃可燃性气体前,先验纯 | |
| C. | 加热固体时,试管口略向下倾料 | |
| D. | 加热液体时,液体体积不超过试管容积的$\frac{1}{3}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化镁 | B. | 氯化钙 | C. | 氯化铝 | D. | 氯化钾 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质(括号内为杂质) | 除杂方法 | |
| A | NaCl(CaCO3) | 溶解、过滤、蒸发 |
| B | FeCl2(CuCl2) | 加入适量铁粉 |
| C | NaOH溶液(NaCl) | 加入适量盐酸 |
| D | CO(CO2) | 通入澄清石灰水并干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
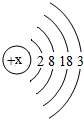 1875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图.
1875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com