
分析 初中常见的6种物质A~F,由H、C、O、Na、S、Ca、Fe中的一种或几种元素组成.
(1)根据B和C的组成元素相同,考虑为二氧化碳与一氧化碳.
(2)根据“D与E组成元素相同,且D可发生分解反应生成E”,推测双氧水的分解.
(3)根据信息“CO2可与Na2CO3溶液反应,生成NaHCO3”,根据反应物、生成物书写化学方程式.
(4)考虑Na2CO3溶液与稀盐酸生成气体.
(5)根据“A的溶液与F的溶液混合后能生成硫酸钠.若需借助无色酚酞溶液才能证明发生反应”,考虑酸碱的中和反应.
(6)盐酸能与碳酸钠、氢氧化钠溶液的反应.
(7)根据“G能与水反应,将适量G加到H的饱和溶液中,溶液中出现浑浊现象”,考虑氢氧化钙微溶.
解答 解:
初中常见的6种物质A~F,由H、C、O、Na、S、Ca、Fe中的一种或几种元素组成.
(1)根据“A分别与不同类别的两种物质发生反应能生成B和C,且B和C的组成元素相同”,而碳与氧化铜反应生成二氧化碳,碳不充分燃烧生成一氧化碳,则反应的化学方程式分别是:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO.
(2)根据“D与E组成元素相同,且D可发生分解反应生成E”,则推测为双氧水分解生成水和氧气,该反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)根据“CO2可与Na2CO3溶液反应,生成NaHCO3”,则此反应的化学方程式为Na2CO3+H2O+CO2=2NaHCO3.
(4)取装有Na2CO3溶液的试管,用滴管滴加入少量的稀盐酸,碳酸钠过量的情况下,生成碳酸氢钠和氯化钠,故无明显现象.
(5)因为A的溶液与F的溶液混合后能生成硫酸钠.若需借助无色酚酞溶液才能证明发生反应,则A与F反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O;若能观察到气泡生成,说明氢氧化钠已于二氧化碳反应生成了碳酸钠,故F中一定含有碳元素.
(6)盐酸能与碳酸钠、氢氧化钠溶液反应,产物完全相同,都为氯化钠,且这两种物质能相互转化:碳酸钠与氢氧化钙反应生成氢氧化钠,而氢氧化钠溶液与二氧化碳反应生成碳酸钠,故这两种物质为碳酸钠、氢氧化钠.
(7)G能与水反应,说明G可能是二氧化碳或氧化钙,H就是氢氧化钙,将适量G加到H的饱和溶液中,溶液中出现浑浊现象,该浑浊物可能为Ca(OH)2或CaCO3;过滤后,滤液中滴加无色酚酞溶液,溶液不变色,说明滤液中无氢氧化钙,那么G就是二氧化碳,G与H溶液反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;若过滤后,向滤渣中加入稀盐酸,没有气泡产生,说明沉淀不是碳酸钙,故H为氧化钙,将适量G加到H的饱和溶液中,氧化钙具有吸水性,会使E的饱和溶液结晶析出氢氧化钙,仍是该温度下的饱和溶液,故溶质的质量分数不变.
故答案为:
(1)2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO.
(2)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑..
(3)Na2CO3+H2O+CO2=2NaHCO3.
(4)无明显现象.
(5)H2SO4+2NaOH═Na2SO4+H2O;碳.
(6)碳酸钠、氢氧化钠.
(7)Ca(OH)2或CaCO3.Ca(OH)2+CO2═CaCO3↓+H2O;等于
点评 本题为文字叙述型物质推断题,完成此题,可以依据题干叙述结合物质的性质进行.要求同学们熟练掌握物质的性质以及有关的实验现象,以便灵活应用.


科目:初中化学 来源: 题型:选择题
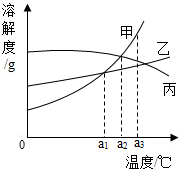
| A. | 把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液 | |
| B. | a2℃时,三种物质饱和溶液中溶质质量分数的大小关系为:甲=丙>乙 | |
| C. | 三种物质的溶解度都随温度的升高而增大 | |
| D. | a3℃时,三种物质的溶解度大小关系:甲>乙>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A.化学与生活 | B.化学与环境 |
| ①生活中常用过滤的方法软化硬水 ②用加热的方法区分热塑性塑料盒热固性塑料 | ①含磷洗涤剂的使用会导致水污染 ②二氧化硫是造成酸雨的原因之一 |
| C.化学与安全 | D.化学与健康 |
| ①在室内放一盆水,可防止煤气中毒 ②夜间发现液化气泄漏开灯寻找泄漏源 | ①食用蔬菜和水果可补充维生素 ②用甲醛的水溶液浸泡海产品保鲜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 推广使用一次性筷子,减少疾病传染 | |
| B. | 废弃塑料可采用焚烧的方法处理,解决“白色污染” | |
| C. | 废旧金属的回收利用,保护金属资源 | |
| D. | 在农田中大量使用化肥、农药,以提高粮食产量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg(OH)2不是可燃物 | |
| B. | Mg(OH)2分解吸热,能降低可燃物的温度 | |
| C. | Mg(OH)2分解吸热,能降低可燃物的着火点 | |
| D. | Mg(OH)2分解的产物能使可燃物与氧气隔绝 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 催化剂 | B. | 还原剂 | C. | 氧化剂 | D. | 干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com