
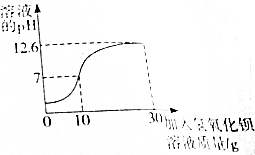
 小曲在实验室发现一瓶标签破损的硫酸,于是对其溶质质量分数迸行测定,取20g此硫酸于烧杯中,逐滴滴加溶质质量分数为17.1%的氢氯化钡溶液,并随时用pH计测定反应后溶液的pH,所得数据如图所示,试回答:
小曲在实验室发现一瓶标签破损的硫酸,于是对其溶质质量分数迸行测定,取20g此硫酸于烧杯中,逐滴滴加溶质质量分数为17.1%的氢氯化钡溶液,并随时用pH计测定反应后溶液的pH,所得数据如图所示,试回答:分析 硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,两者恰好完全反应时溶液的pH=7,此时消耗氢氧化钡溶液的质量为10g,由反应的化学方程式,列式计算出参加反应的硫酸的质量,进而计算出所测硫酸中溶质的质量分数.
解答 解:(1)恰好完全反应时,溶液的pH=7,加入氢氧化钡溶液的质量为10g.
(2)10g氢氧化钡溶液中溶质的质量为10g×17.1%=1.71g.
Ba(OH)2+H2SO4═BaSO4↓+2NaOH
171 98
1.71g x
$\frac{171}{98}=\frac{1.71g}{x}$ x=0.98g
计算所测硫酸中溶质的质量分数为$\frac{0.98g}{20g}$×100%=4.9%.
答:(1)10;(2)所测硫酸中溶质的质量分数为4.9%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
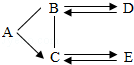 已知A、B、C、D、E是初中化学常见的不同类别的五种物质,D是一种红色固体,B→D的反应过程较为复杂,D→B的反应用于冶金工业,中“-”表示相连物质可以发生反应,“→”表示一种物质生成另一种物质(部分反应物、生成物及反应条件省略).
已知A、B、C、D、E是初中化学常见的不同类别的五种物质,D是一种红色固体,B→D的反应过程较为复杂,D→B的反应用于冶金工业,中“-”表示相连物质可以发生反应,“→”表示一种物质生成另一种物质(部分反应物、生成物及反应条件省略).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
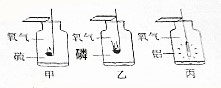 如图是三种物质在氧气中燃烧的实验.
如图是三种物质在氧气中燃烧的实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ,请回答该图标的含义是回收标志,从化学学科的角度谈谈使用塑料制品的利轻便耐磨 和弊废弃的塑料制品会带来白色污染.
,请回答该图标的含义是回收标志,从化学学科的角度谈谈使用塑料制品的利轻便耐磨 和弊废弃的塑料制品会带来白色污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com