
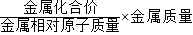 ”求得;
”求得;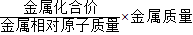
 ≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、镁、铝与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;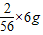 ≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;
≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的N的镁能与酸反应,铁粉中混有镁时放出氢气的质量偏大,故C选项不正确;

科目:初中化学 来源: 题型:
| A、Mg、Cu | B、Fe、Al | C、Al、Mg | D、Cu、Mg |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Mg、Cu | B.Fe、Al | C.Al、Mg | D.Cu、Mg |
查看答案和解析>>
科目:初中化学 来源: 题型:
现有不纯的锌6g(含杂质金属M)和不纯的铁6g(含杂质金属N),当它们分别与足量的稀硫酸反应至不再产生氢气时,得到氢气的质量都是0.2g,则M、N可能是( )
A.Mg和Cu B.Fe和Al C.Al和Mg D.Cu和Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com