
| 1 |
| 12 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:
(2013?大庆)下表是常见的几种酸、碱、盐在水溶液中解离出来离子的情况,根据表中信息分析,得出的结论正确的是( )
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目:初中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?大庆)在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.
(2013?大庆)在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.| 实验操作 | 实验现象 | 实验结论及解释 | |
| ① |  |
氢氧化钠溶液可以与CO2反应. 反应的化学方程式为: CO2+2NaOH═Na2CO3+H2O CO2+2NaOH═Na2CO3+H2O | |
| ② |  |
气球膨胀 气球膨胀 |
氢氧化钠溶液可以与CO2反应. |
| ③ |  洗气瓶中的溶液均为氢氧化钠溶液或澄清石灰水(均为200mL) |
A,B均无明显变化 | 氢氧化钠溶液可以与CO2反应. B中盛放的溶液是 澄清石灰水 澄清石灰水 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
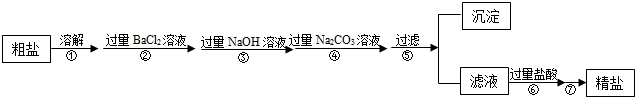
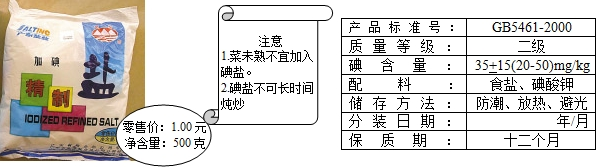
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com