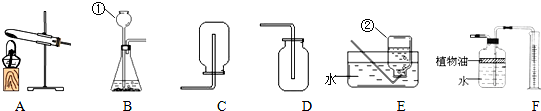
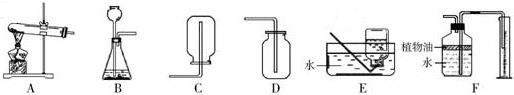
解:(1)如果用双氧水制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.故答案为:2H
2O
2 
2H
2O+O
2↑; C或D; 氢气(或二氧化碳)
(2)实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;故答案为:A、C(或A、E)
(3)用B装置制取氧气时,试管中的棉花没有发生燃烧,根据燃烧的条件分析,其主要原因是:温度没有达到棉花的着火点;故答案为:温度没有达到棉花的着火点
(4)F装置中,在水面上放一层植物油的目的是:防止二氧化碳溶于水或与水反应,植物油上方原有的空气对实验的结果没有影响;故答案为:防止二氧化碳溶于水或与水反应(答出一点不给分);没有
(5)将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是:无色酚酞变成红色且集气瓶中的液面上升,因为氨气极易溶于水的气体,并且氨气分子是不断运动的;故答案为:无色酚酞变成红色且集气瓶中的液面上升(答出一点不给分)
分析:燃烧的条件有:可燃物与氧气接触;可燃物必须达到着火点;制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.F装置中,在水面上放一层植物油的目的是:防止二氧化碳溶于水或与水反应,植物油上方原有的空气对实验的结果没有影响;将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是:无色酚酞变成红色且集气瓶中的液面上升,因为氨气极易溶于水的气体,并且氨气分子是不断运动的.
点评:本考点主要考查了燃烧的条件、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 2H2O+O2↑; C或D; 氢气(或二氧化碳)
2H2O+O2↑; C或D; 氢气(或二氧化碳)