B
试题分析:根据题意书写各金属与稀盐酸反应的化学方程式,再利用各金属与氢气的质量比,计算出相同质量的各金属(可均取1g)分别与足量稀盐酸反应生成的氢气的质量,最后进行比较即可。
A、Mg+H
2SO
4=MgSO
4+H
2↑
24 2
1g x
24:2=1g:x
解得x=
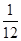
g
即1g镁生成
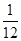
克氢气;
B、2Al+3H
2SO
4= Al
2(SO
4)
3+3H
2↑
54 6
1g y
54 :6=1g :y
解得y=

g
即1g铝生成

克氢气;
C、由于铜的活动性排在氢的后面,故不能与盐酸反应生成氢气,即气体为0;
D、Zn+H
2SO
4= ZnSO
4+H
2↑
65 2
1g z
65 :2=1g :z
解得z=

g
即1g锌生成
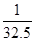
克氢气。由此可判断,质量相同的金属,与足量的稀盐酸充分反应后,放出氢气最多的是Al。故选B
考点:金属的化学性质,根据化学反应方程式的计算
点评:熟练掌握金属与酸反应的化学方程式,并能灵活应用金属与氢气间的固定质量比进行计算,是解答本题的关键。

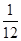 g
g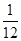 克氢气;
克氢气; g
g 克氢气;
克氢气; g
g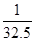 克氢气。由此可判断,质量相同的金属,与足量的稀盐酸充分反应后,放出氢气最多的是Al。故选B
克氢气。由此可判断,质量相同的金属,与足量的稀盐酸充分反应后,放出氢气最多的是Al。故选B
