
【题目】达州市钢铁厂用于炼铁的铁矿石主要主要成分是菱铁矿[FeCO3],课外小组同学取来该铁矿石样品12.5g,粉碎后,将125g一定溶质质量分数的稀盐酸分5次加入到该样品中,所测数据如下(杂质不与稀盐酸反应,也不溶于水):
次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 9.6 | 6.7 | 3.8 | 0.9 | 0.9 |
(1)第次恰好完全反应。
(2)该23200t这样的铁矿石理论上能冶炼得到铁的质量为。
(3)求加入稀盐酸恰好完全反应时所得溶液的溶质质量分数?(结果保留到0.1%)
【答案】
(1)四
(2)10393.6t
(3)解:设生成FeCl2和CO2的质量分别为x、y,
FeCO3+2HCl= | FeCl2+H2O+ | CO2↑ |
116 | 127 | 44 |
11.6g | x | y |
![]()
x=12.7g,y=4.4g,
FeCl2的质量分数为 ![]() ×100%=11.8%,
×100%=11.8%,
答:FeCl2的质量分数为11.8%。
【解析】(1)由表中数据可知,第四次反应后剩余固体质量不再减小,说明第四次恰好完全反应;(2)由数据可知,铁矿石样品12.5g,中含有FeCO3的质量为12.5g-0.9g=11.6g
23200t这样的铁矿石中FeCO3的质量为 ![]() =21529.6t
=21529.6t
根据质量守恒定律,FeCO3中的铁将转化为铁;石理论上能冶炼得到铁的质量为21529.6t× ![]() ×100%=10393.6t。
×100%=10393.6t。
所以答案是:四;10393.6t;设生成FeCl2和CO2的质量分别为x、y,
FeCO3+2HCl= | FeCl2+H2O+ | CO2↑ |
116 | 127 | 44 |
11.6g | x | y |
![]()
x=12.7g,y=4.4g,
FeCl2的质量分数为 ![]() ×100%=11.8%,
×100%=11.8%,
答:FeCl2的质量分数为11.8%。
【考点精析】掌握质量守恒定律及其应用和根据化学反应方程式的计算是解答本题的根本,需要知道①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比.


科目:初中化学 来源: 题型:
【题目】小明同学为了探究铜、铁、银三种金属的活动性强弱,做了如下实验。他找来一块铜片,用砂纸打磨干净,然后分别在a、b、c三处滴上不同的溶液:
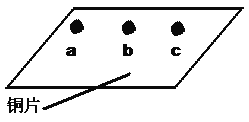
①在a处滴上稀HCl ;②在b处滴上FeSO4溶液 ;③在c处滴上AgNO3溶液.一段时间后观察a、b、c三处,无明显变化的地方是_____;写出有明显现象的地方所涉及的化学反应方程式:___________;以上实验中,你认为小明不必要进行的是____(选填“①”“②”或“③”);据此实验,你认为小明得出的金属活动性正确结论的是_________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3和KCl在不同温度时的溶解度曲线如图所示,下列说法正确的是( )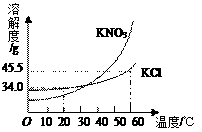
A.温度低于40℃时,KNO3的溶解度一定小于KCl的溶解度
B.将等质量的KNO3和KCl的饱和溶液从60℃降温到20℃,析出晶体的质量KNO3大于KCl
C.将10℃时KNO3、KCl的饱和溶液升温至60℃,KNO3溶液中溶质的质量分数比KCl大
D.将20℃时100gKCl的饱和溶液升温至60℃,需要再加入11.5gKCl固体才能使溶液恰好饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“十二五”期间,达州市共对37家排污单位进行立案调查,取缔部分畜禽养殖场,新建城市污水处理厂3个。
(1)水源地附近建立畜禽养殖场可能导致 。污水处理厂待处理污水发出阵阵恶臭,从微观角度分析能闻到阵阵恶臭的的主要原因是。(填序号A.分子的质量很小 B.分子在不断运动着 D.分子间有间隔)可用 除去其臭味。
(2)污水处理厂工作人员测得待处理污水PH=6.3,该污水显(选填“酸性”“碱性”“中性”),可以向其中加入。
(3)污水处理中漂白粉可用水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应:Ca(ClO)2+X+H2O=CaCO3↓+2HClO,则X的化学式为。
(4)漂白粉的制取中需要用到氯气,实验室制氯气的原理:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,氯气是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,不易溶于饱和氯化钠溶液。氯气能与金属单质反应,能与强碱溶液反应。(如漂白粉的制取中氯气通入氢氧化钙溶液中,反应生成次氯酸钙、氯化钙和水。)
MnCl2+Cl2↑+2H2O,氯气是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,不易溶于饱和氯化钠溶液。氯气能与金属单质反应,能与强碱溶液反应。(如漂白粉的制取中氯气通入氢氧化钙溶液中,反应生成次氯酸钙、氯化钙和水。)
①图1是氯气的实验室制法装置图,请根据图2所提供仪器将图1补充完整:A 应该选择装置 ,X处导管应该链接装置I的端。
②E装置的作用是 , 其发生反应的化学方程式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消灭污染,是一门彻底阻止污染产生的科学,它包括“绿色生产”和“绿色销毁”等内容。2009年我市在整顿音像市场的活动中,查获了一批盗版光盘,并进行了“绿色销毁”。以下做法属于”绿色销毁”的是( )
A.泼上汽油焚烧B.倾倒入大海中
C.深埋于土中D.碾压粉碎后回收再利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com