解:(一)[问题讨论]
(1)由图2可知Na
2CO
3和Ca(OH)
2混合后有新物质CaCO
3生成及自由钠离子和氢氧根,所以方程式为:Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH;;
由图3可知NaHCO
3与澄清石灰水混合,反应前的离子有Na
+、OH
-、HCO
-3、Ca
2+,反应后有新物质CaCO
3、H
2O、Na
+、CO3
2-,对比前后可知参加反应的离子有OH
-、HCO
-3、Ca
2+
(2)CaCl
2与Na
2CO
3溶液的发生复分解反应,方程式为Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl;CaCl
2与NaHCO
3溶液混合,根据所给信息CaCl
2+2NaHCO
3=CaCO
3↓+2NaCl+CO
2↑+H
2O,可知该反应既有白色沉淀又有气体产生,而碳酸钠和CaCl
2溶液反应只有沉淀生成,所以乙同学是根据有无气泡产生将二者区别开的.
(3)碳酸氢钠受热易分解,2NaHCO
3 
Na
2CO
3+CO
2↑+H
2O,生成的CO
2气体通入澄清石灰水中发生反应,
CO
2+Ca(OH)
2=CaCO
3↓+H
2O 生成碳酸钙沉淀变浑浊.
[拓展应用]
(1)可以利用NaHCO
3的不稳定性,采用加热方法将其转换为碳酸钠.(2)加入适量的NaOH溶液,将其转换为Na
2CO
3,方程式为 NaHCO
3+NaOH=Na
2CO
3+H
2O
故答案为:
[问题讨论]
(1)Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH; OH
-、HCO
-3、Ca
2+
(2)有无气泡产生.
(3)空气受热膨胀,不易,澄清石灰水变浑浊(或小试管中有大量气泡产生或大试管管口有水珠等).
[拓展应用]
(1)加热
(2)NaOH
(二)【提出问题】:碳酸钠、氯化铜、氯化铵、氯化钠都属于盐类物质;
【表达与交流】:①A试管中产生白色沉淀;C试管中发生反应的化学方程式是:2NH
4Cl+Ca(OH)
2=CaCl
2+2NH
3↑+2H
2O;有些化学反应没有明显的现象,不能因为没有现象就判定没发生化学反应;
②氢氧化钙溶液与氯化铜溶液反应生成了氢氧化铜沉淀和氯化钙,反应后的溶液是无色的,溶液中溶质一定有氯化钙,一定没有氯化铜,可能有氢氧化钙,通过通入二氧化碳和加入酚酞试液的方法来进行确定.
【反思与评价】:B试管中的废液显碱性,不能直接排放,必须将碱性物质调节至中性再排放.
故答案为:【提出问题】:盐;
【表达与交流】:①不合理;有些化学反应无明显现象
②
| 实验内容 | 实验现象 | 实验结论 |
| 滴加无色酚酞溶液 | 无色酚酞溶液便红色 |
氢氧化钙和氯化钙 |
| 滴加氯化铁溶液 | 生成红褐色沉淀 |
| 或通入二氧化碳气体 | 产生白色沉淀 |
【反思与评价】:将碱性物质调节至中性(答案合理即可)
(三)①碳酸钙和碳酸氢钾的相对分子质量都是100,含碳酸根的质量相同,故2g混合物可看做是一种物质如碳酸钙的质量,设2g碳酸钙和盐酸反应生成二氧化碳的质量为x
CaCO
3~CO
2
100 44
2g x
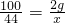
x=0.88g
由于2g碳酸钙和碳酸氢钾不管以何种质量比混合时生成的二氧化碳都是0.88g,故不能由气体质量计算出混合物中两成分的质量比;
(2)根据碳酸氢钾易分解,碳酸钙需要高温分解的性质,从图象中可看出b的质量是碳酸氢钾分解生成二氧化碳的质量,碳酸钙分解生成二氧化碳的质量就为(c-b)g,碳酸钙和碳酸氢钾的质量比就是生成二氧化碳的质量比,故m(CaCO
3):m(KHCO
3)═(c-b):b.
(2).①0.88 不能 ②(c-b):b
分析:(一)[问题讨论](1)通过分析图中有关反应物混合前后离子的变化,可以写出反应方程式和参与反应的离子.
(2)根据所给信息CaCl
2+2NaHCO
3=CaCO
3↓+2NaCl+CO
2↑+H
2O,可知该反应既有白色沉淀又有气体产生,而碳酸钠和
CaCl
2溶液反应只有沉淀生成.
[拓展应用](1)因为碳酸氢钠不稳定,可用加热进行除杂.
(2)可以采用转化法将碳酸氢钠转化为碳酸钠.
(二)利用与氢氧化钙反应的物质的组成判断其分类;有些化学反应没有明显的现象,不能因为没有现象就判定没发生化学反应;氢氧化钙溶液与氯化铜溶液反应生成了氢氧化铜沉淀和氯化钙,反应后的溶液是无色的,溶液中溶质一定有氯化钙,一定没有氯化铜,可能有氢氧化钙,通过加入氯化铁和加入酚酞试液的方法来进行确定.
(三)(1)因为CaCO
3、KHCO
3相对原子质量均为100,里面碳酸根的比例相等,利用这一知识和突破口解决.
(2)根据碳酸氢钾和碳酸钙分解的温度判断生成二氧化碳的质量,然后计算质量比.
点评:本题信息量、阅读量很大,首先必须要认真理解题意,通读题目后,再结合课本已有知识进行解题.

 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______ Na2CO3+CO2↑+H2O,生成的CO2气体通入澄清石灰水中发生反应,
Na2CO3+CO2↑+H2O,生成的CO2气体通入澄清石灰水中发生反应,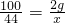 x=0.88g
x=0.88g

 (2006?建邺区一模)家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
(2006?建邺区一模)家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.

