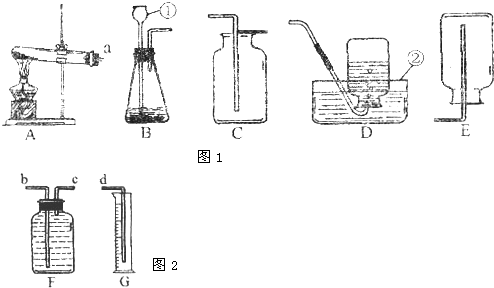
解:(1)要熟记常见仪器的名称:①长颈漏斗;②水槽;
(2)制取H
2是用固态的锌粒和液态的稀硫酸在常温下不需要加热,故发生装置的特点属于反应物的状态是固体和液体,不需要加热的B;用D排水法或E向下排空气法装置收集H
2,说明H
2具有不易溶于水,密度比空气小的性质;
(3)氧化氢溶液在催化剂的作用下分解生成水和氧气,反应的方程式是2H
2O
2
2H
2O+O
2↑;氧气难溶于水,可用排水法收集,欲得到较纯净的氧气,选用排水法收集,氧气密度比空气大,收集满后集气瓶要正放在桌面上;
(4)高锰酸钾分解生成锰酸钾、二氧化锰、氧气,反应的化学方程式是2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(5)该装置是利用排水法收集氧气,且通过量筒测定水的体积从而知道气体的体积,故产生的氧气通过短管进入,把水排入量筒;
故答案为:(1)长颈漏斗;水槽;
(2)B;不易溶于水,密度比空气小;
(3)2H
2O
2
2H
2O+O
2↑;排水;正放;
(4)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(5)c;b.
分析:(1)熟练掌握常见化学仪器的名称及其用途;
(2)根据反应物的状态和反应条件来选择发生装置;根据气体的密度和溶解性选择相应的收集方法;
(3)根据过氧化氢溶液制取氧气的反应原理结合氧气的性质分析考虑;
(4)根据用高锰酸钾制取O
2的实验原理分析考虑;
(5)根据测定气体体积的原理分析.
点评:本题考查了常见气体的制取和收集以及实验的注意事项等,难度不大,但关键是明确实验的原理.


 2H2O+O2↑;氧气难溶于水,可用排水法收集,欲得到较纯净的氧气,选用排水法收集,氧气密度比空气大,收集满后集气瓶要正放在桌面上;
2H2O+O2↑;氧气难溶于水,可用排水法收集,欲得到较纯净的氧气,选用排水法收集,氧气密度比空气大,收集满后集气瓶要正放在桌面上; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; 2H2O+O2↑;排水;正放;
2H2O+O2↑;排水;正放; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案