
ijУ��ѧ��ȤС��ιۼ�ʽ̼��þ��������֪������ˮ��þʯ(��Ҫ�ɷ�ΪMgCl2��6H2O)Ϊԭ��������ʽ̼��þ[xMgCO3��yMg(OH)2��zH2O]����Ҫ�������£�


���������ۡ�
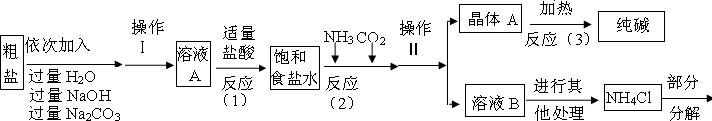
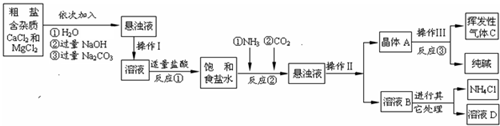
��1��������������Һ����Ҫ���ʣ�д��ѧʽ�� ����������������Ҫ�õ��Լ��У�����ţ� ��
A. ������ B. ϡ���� C. ��ɫʯ����Һ D. ��������Һ
��2������������NH3��ѭ��ʹ�ã�����������NH3�Ļ�ѧ����ʽΪ ��
��3�������С����ȡ� ��һ����ÿ����l������xMgCO3��yMg(OH)2��zH2O�����İ��ķ�����Ϊ ���ô���ʽ����
��4���жϼ�ʽ̼��þ�Ƿ�ϴ�Ӹɾ������Բ�ȡ������ϴ��Һ�еμӣ�����ţ� ��Ȼ��۲������жϡ�
A. ������Ȼ����Ļ��Һ B. ������������Ļ��Һ C.̼������Һ D.ϡ����
�����̽��һ��
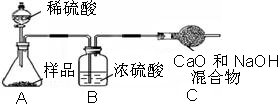
��5����֪�������ռ�ʽ̼��þ�õ�MgO��������װ�����ʵ��ⶨ��ʽ̼��þ����ɣ�װ�����Ӵ���������ΪA�� �� ��D��

��6��ȡ��ʽ̼��þ4.66g���������������أ��õ�����2.00g��CO21.76g��ͨ������ȷ����ʽ̼��þ�Ļ�ѧʽΪ ����2�֣���
������̣�3��)
�����̽������
��7����ͬѧ�������������飬��Ϊ��������á���Ŀ����ǣ�����ţ� ��
A.ͬ�� B. ��ͬ�� C. ��ȷ��
��������� ��
��8���Ƶõ���Һ����Ϊ g [��ʾ�����â�������]
�����̽������
��Ϊ��ȷ�IJ�����ʽ̼��þ���ȷֽ������ʱ����ʣ������������������µ�����ͼ
��9���Իش�

�ټ���ʱ���þ��忪ʼ������ѧ�仯��ʱ���� (�t1������t3����t5��)��
��t4��t5ʱ��ι���Ϊ��д��ѧʽ�� ��MgO�Ļ���
��t2��t3ʱ��ι���Ļ�ѧʽΪ���ú�x��y�Ļ�ѧʽҲ��ԣ� ��
(1) NH4Cl AC (2) 2NH4Cl+ CaO = CaCl2 + 2NH3��+ H2O (3) 2(x+y)
(4)B (5)CB (6) 4MgCO3��Mg(OH)2��4H2O �����̷ֲ����֣� 3��)
(7)A �ؼ���: HCl �ӷ��ݳ� (8)22.9
(9) �� t1 ��Mg(OH)2 ��xMgCO3��yMg(OH)2��4MgCO3��Mg(OH)2
��������
������������������ۡ�
��1�����ݷ�Ӧ���̿�֪�����Ȼ�þ��Һ�м��백���Ͷ�����̼��Ӧ���ɼ�ʽ̼��þ���ٸ��������غ㶨���е�Ԫ���غ��֪����Ӧ����һ������ӦΪ�Ȼ�泥���NH4Cl����������ͼ�е���Һ�������ƣ��ܷ�Ӧ�ų�������֪��Ҫ�����������ӡ���笠����ӣ���ȡ���������ʷ����Թ��У��������������ƣ����ھƾ��ƻ������ȣ�Ȼ�������������ͨ����ɫʯ����Һ����ʯ�����ɫ������֤���������к���笠����ӡ���ѡAC
��2����������ͼ����ϸ��ֽⷴӦ�Ĺ��ɿ�֪���Ȼ���������Ʒ�Ӧ���������Ȼ��ơ�������ˮ��������������NH3�Ļ�ѧ����ʽΪ2NH4Cl+ CaO = CaCl2 + 2NH3��+ H2O��
��3�����ݻ�ѧ�仯�е�ԭ�����������������������С����ȡ� ��һ���ڣ� ÿ����l������xMgCO3��yMg(OH)2��zH2O�����İ��ķ�����Ϊ2(x+y)��
��4������ʽ̼��þûϴ�Ӹɾ���������ϴ��Һ�лẬ���Ȼ�泥��ʿ������еμ�������������Ļ��Һ�������ֲ�������İ�ɫ�Ȼ�����������ѡB
�����̽��һ��
��5���������⣬���ͼʾ��֪��Ҫͨ��ʵ��ⶨ��ʽ̼��þ����ɣ���ⶨ��Ӧ���ɵĶ�����̼��ˮ�����������ڴӳ���ʯ��ˮ�г����������Я��ˮ����Ӱ��ʵ�����IJⶨ����Ҫ�����ղⶨˮ�����������װ�����Ӵ���������ΪA��C��B��D��
��6���������⣬��ʽ̼��þ�������գ���������þ��ˮ�Ͷ�����̼����������֪����ʽ̼��þ4.66g��Ӧ��������þ2.00g��������̼1.76g������������غ㶨�ɿ�֪������ˮ������Ϊ4.66g-2.00g-1.76g=0.9g���ɴ˿�֪��m��MgO����m��CO2����m��H2O��="2.00g:" 1.76g: 0.9g=100:88:45���ɽ�xMgCO3��yMg(OH)2��zH2O���γ�(x+y)MgO��xCO2��(y+z)H2O������40(x+y)��44x��18(y+z)= 100:88:45�����x:y:z=4:1:4������ʽ̼��þ�Ļ�ѧʽΪ4MgCO3��Mg(OH)2��4H2O��
�����̽������
��7������������лӷ��ԣ���ӷ��ݳ��Ȼ������壬�ʳ�������Һ��������ƫС�����������ᡣ
��8�����������֪����ʽ̼��þ���ᷴӦ�������Ȼ�þ�Ͷ�����̼���壬���������غ㶨���е�Ԫ���غ㣬��ϣ�6����֪��4.66g��ʽ̼��þ���ᷴӦ���ɵĶ�����̼������ҲӦΪ1.76g������Һ����Ϊ4.66g +20g-1.76g=22.9g��
�����̽������
��9���ٸ���ͼʾ��֪������ʱ���þ�����t1ǰ����û�б仯����û�з�Ӧ��t1ʱ������ʼ��С��˵����ʼ������ѧ�仯��
�۸������⣬��ϼ�ʽ̼��þ�Ļ�ѧʽ4MgCO3��Mg(OH)2��4H2O������4.66g��ʽ̼��þ���ȷֽ�����У���t1��t2ʱ��Σ����ٵ���������Ϊ4.66g-3.94g=0.72g��ǡ��Ϊ��ᾧˮ���������ɴ˿�֪���ڸ�ʱ��Σ���ʽ̼��þ��ʼ��Ӧʧȥ�ᾧˮ������t2��t3ʱ����������ټ��٣���˵����ʱ�ᾧˮ����ȫʧȥ���ʴ�ʱ����Ϊ4MgCO3��Mg(OH)2��
����t3��t4ʱ��Σ����ٵ���������Ϊ3.94g-2.18g=1.76g��ǡ��Ϊ��Ӧ���ɵĶ�����̼���������ɴ˿�֪���ڸ�ʱ��Σ�4MgCO3��Mg(OH)2��ʼ��Ӧ���ų�������̼���壬��t4��t5ʱ��Σ�ʣ�����������ֲ��ټ����ˣ���˵����ʱMgCO3����ȫ��Ӧ��������þ�Ͷ�����̼���ʴ�ʱ����ΪMg(OH)2��MgO�Ļ���
���㣺֤����Σ�NH4+���鷽������Cl-�ļ��鷽����ʵ�鷽������������ۣ�ʵ��̽�����ʵ���ɳɷ��Լ���������д��ѧ����ʽ�������غ㶨�ɼ���Ӧ�ã��йػ�ѧʽ�ļ���
����������̽����ʵ��̽����Ҫ��Ϥʵ��̽���Ļ��ںͷ������������ʵ�鷽��������ѧ��̽�����ʵ����ʻ�仯���ɵļ���Ǩ�����ˣ�����ϸ�ĵ�̽��ʵ��۲�������ͨ������ʵ�������ƶϡ��ܽ�������ʵ����ʻ�仯���ɵȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ
С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ���� | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| �ܽ�� | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| ʵ��һ | ʵ��� | ʵ���� | ʵ���� | |
| ����������Һ���� | 100g | 100g | 100g | 100g |
| ����CaCl2��Һ���� | 10g | 20g | 30g | 40g |
| ���ɵij��������� | 4g | m | 10g | 10g |
| ��ҵ���������Na2CO3% �� | |||
| �ŵ�Ʒ | һ��Ʒ | �ϸ�Ʒ | ��Ʒ |
| ��95 | ��80 | ��75 | ��40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ���� | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| �ܽ�� | 36.0g[ | 9.6g | 37.2g | 710 | 0.9 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||

| ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� |
������ɫ���ݣ�����ʯ��ˮ����� ������ɫ���ݣ�����ʯ��ˮ����� |
����Ʒ��NaHCO3������Na2CO3 ����Ʒ��NaHCO3������Na2CO3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com